Содержание
уход в домашних условиях, пересадка и размножение
Пальма кариота относится к числу самых необычных пальм, выращиваемых в домашних условиях. Ее эффектная пышная листва обладает оригинальной формой. Эту комнатную пальму вы с легкостью сможете отличить от многих других. И несмотря на то, что кариота имеет совсем немного видов и сортов, все равно она считается одной из самых красивых и крупных домашних пальм.
Такое растение нетребовательно к уходу. Но при этом следует учесть, что для его нормального роста и развития необходима повышенная влажность воздуха. В остальном пальма довольно неприхотлива. При этом чем взрослее растение, тем меньше внимания к нему требуется со стороны цветовода.
Особенности пальмы кариота
Пальма кариота имеет необычный внешний вид, что бросается в глаза даже с большого расстояния. Особенно выделяются у этого растения удивительные листовые пластины. Они поражают своей величиной, а также нетипичной для пальм ассиметричной причудливой формой. В природных условиях такую пальму можно повстречать в тропиках, именно поэтому она предпочитает повышенную влажность воздуха. Это растение считается неприхотливым и крайне выносливым, что позволяет без проблем выращивать его в комнатных условиях. Его характерной чертой является невероятно пышная листва, имеющая необычную форму, что придает пальме особый причудливый вид.
В природных условиях такую пальму можно повстречать в тропиках, именно поэтому она предпочитает повышенную влажность воздуха. Это растение считается неприхотливым и крайне выносливым, что позволяет без проблем выращивать его в комнатных условиях. Его характерной чертой является невероятно пышная листва, имеющая необычную форму, что придает пальме особый причудливый вид.
Такая сравнительно крупная пальма является вечнозеленой. В природных условиях ее высота может доходить до нескольких десятков метров. При этом домашние экземпляры, как правило, имеют высоту не более 150–200 см. Данная пальма может быть представлена в форме одноствольного дерева либо эффектным кустистым растением, имеющим множество стволом, причем спустя некоторое время она формирует полноценные заросли.
Большие листовые пластины являются дважды перистыми. Больше всего листья выделяются не своими размерами, а необычной формой, которая нехарактерна для представителей семейства Пальмовые. Рассеченные листовые пластины не имеют долей ланцетной формы, как «классические» пальмы. Вместо это на них красуются оригинальные широкие перышки ассиметричной формы. Эти перышки похожи на усеченные косые клинья, верхняя часть которых словно оторвана. Листва кажется воздушной и легкой, трепещущей даже от небольшого ветерка. Этому способствуют довольно длинные черешки листовых пластин, имеющих неправильную треугольную форму, края которых неравномерно зубчатые. Кромка у листвы словно разорванная.
Вместо это на них красуются оригинальные широкие перышки ассиметричной формы. Эти перышки похожи на усеченные косые клинья, верхняя часть которых словно оторвана. Листва кажется воздушной и легкой, трепещущей даже от небольшого ветерка. Этому способствуют довольно длинные черешки листовых пластин, имеющих неправильную треугольную форму, края которых неравномерно зубчатые. Кромка у листвы словно разорванная.
Увидеть цветущую домашнюю кариоту — это очень большая редкость. И даже в ботанических садах такая тропическая красавица радует своим цветением нечасто. Пальма, растущая в природных условиях, впервые зацветает после того, как ей исполнится не меньше 10 лет. Цветение длится непрерывно на протяжении 5–7 лет. После этого цветение кариоты заканчивается и больше она не цветет. Для того чтобы на таком растении появились соцветия, ему следует обеспечить оптимальную влажность воздуха. Необычные крупные соцветия состоят из разветвленных початков. Форма початков внешне похожа на хвосты лошадей, из-за того что в их состав входят несколько сотен тонких поникающих веточек.
Формирование соцветия происходит в листовых пазухах, при этом волна цветения двигается от верхушки кроны пальмы к ее основанию. То есть изначально соцветия образуются в пазухах верхних листовых пластин, но за тем наблюдается их постепенное опускание вниз. Эта пальма интересна еще и тем, что когда цветение добирается до нижней части кроны, на верхней — уже наблюдается созревание плодов. После того как плоды полностью вызреют, у куста начинают активно отмирать стебли. Если взрослая пальма имеет один ствол, то по окончанию плодоношения она гибнет. При этом у кустистых форм возможно возобновление за счет прикорневых отростков. У плодов внутри располагаются кристаллы игловидной формы, малоприятные на ощупь. Они могут с легкостью повредить кожу.
Уход за пальмой кариота в домашних условиях
Кустистая пальма кариота с пышной кроной, состоящей из множества необычных листовых пластин формой похожих на хвосты рыб, имеет славу особенной высокодекоративной пальмы. Также это растение отличается от остальных пальм и своим характером. Его с легкостью можно выращивать в домашних условиях. Это растение очень выносливо и нетребовательно как к уходу, так и к условиям выращивания.
Его с легкостью можно выращивать в домашних условиях. Это растение очень выносливо и нетребовательно как к уходу, так и к условиям выращивания.
От многих иных пальм кариота отличается тем, что хорошо переносит зимовку в теплой комнате, а также практически не реагирует на многие ошибки в уходе. Но если вы хотите, чтобы пальма была пышной и красивой, следует обеспечить ей оптимальную влажность воздуха и правильный режим полива. Несмотря на это, уход за кариотой не составит особого труда, даже если вы новичок в цветоводстве. А еще плюс этой культуры в том, что при необходимости ее можно с легкостью размножить вегетативным способом.
Освещенность
Несмотря на то, что это светолюбивое растение, оно негативно реагирует на палящие прямые лучи солнца. Если поставить куст на солнечное окно, то это может стать причиной появления серьезных ожогов и травм. В связи с этим растить такую пальму можно лишь под рассеянными солнечными лучами. При этом помните, что утренние лучи солнца могут особенно сильно навредить кариоте. Если вы решили поставить пальму на южное окно, тогда для нее рекомендуется выбрать место в глубине комнаты или на окно можно установить рассеивающий экран. Оптимальным вариантом для размещения кариоты являются окна западной или восточной ориентации.
Если вы решили поставить пальму на южное окно, тогда для нее рекомендуется выбрать место в глубине комнаты или на окно можно установить рассеивающий экран. Оптимальным вариантом для размещения кариоты являются окна западной или восточной ориентации.
При выборе места для кариоты следует помнить, что она негативно реагирует на перегрев системы корней. Именно поэтому ее рекомендуется поставить непосредственно на пол или на низкую подставку, при этом следует выбрать такое место, чтобы свет падал на растение сверху (данное требование выполнить желательно, но необязательно). Помните о том, что эта тропическая гостья не способна расти даже в небольшом затенении. При нехватке света наблюдается замедление ее роста, при этом куст постепенно утрачивает свой эффектный внешний вид.
Температурный режим
Пальма кариота прекрасно себя чувствует при обычной комнатной температуре характерной для жилых помещений. От большинства других представителей семейства Пальмовые это растение отличается тем, что ему не нужна холодная зимовка. Более того оно крайне негативно относится к холоду, ему может навредить даже незначительное похолодание (до 18 градусов). Если в осенне-зимний период температура в комнате будет ниже 18 градусов, это может погубить пальму.
Более того оно крайне негативно относится к холоду, ему может навредить даже незначительное похолодание (до 18 градусов). Если в осенне-зимний период температура в комнате будет ниже 18 градусов, это может погубить пальму.
Как в тепле, так и в жаре растение себя чувствует хорошо. Однако при этом следует учесть, что чем теплее будет в комнате, тем более высокий уровень влажности воздуха нужно обеспечить кариоте. Причем наиболее благоприятной для роста и развития кариоты является температура воздуха 22–24 градуса.
Выносить кариоту на улицу в теплое время года крайне нежелательно, потому что она может отреагировать на это крайне негативно. Такое растение не приветствует внезапную смену условий содержания, а еще ему могут навредить сквозняки. Для его размещения рекомендуется выбрать место в жилом помещении с оптимальной температурой и достаточным количеством рассеянного света. При этом переставлять пальму крайне нежелательно. А так как она довольно крупная и тяжелая, то перетаскивать ее с места на место вряд ли кому-то захочется. Помните о том, что если перенести куст на балкон, террасу либо в сад, то ему могут нанести ощутимый вред не только сквозняки, но вредители.
Помните о том, что если перенести куст на балкон, террасу либо в сад, то ему могут нанести ощутимый вред не только сквозняки, но вредители.
Полив
С подбором правильного режима полива кариоты не должно возникнуть особых проблем. Ее нужно поливать умеренно, но регулярно, причем следите за тем, чтобы субстрат в емкости был постоянно немного влажноватым. Растение одинаково плохо реагирует и на пересушку земляного кома, и на застой влаги в корнях.
Если полив будет редким или чрезмерно скудным, то это может стать причиной частичного облетания листовых пластин, что крайне негативно отразится на внешнем виде куста. В связи с этим обязательно следите за тем, чтобы земляной ком в горшке никогда не пересыхал.
В весенне-летний период поливы должны быть довольно частыми. Причем субстрат в горшке рекомендуется увлажнять сразу же после того, как просохнет его верхний слой. С наступлением осеннего периода и в зимнее время растение поливают более скудно и редко. В это время увлажнение почвосмеси проводят только тогда, когда подсохнет ее верхний слой толщиной от 30 до 50 мм. Какое бы время года не было спустя некоторое время после полива обязательно освободите поддон от стекшей в него воды.
Какое бы время года не было спустя некоторое время после полива обязательно освободите поддон от стекшей в него воды.
Влажность воздуха
Выше уже говорилось о том, что кариота нуждается в высокой влажности воздуха в любое время года. Чтобы эти показатели всегда были оптимальными, необходимо регулярно предпринимать меры по увеличению уровня влажности воздуха. Однако в этом случае вполне можно обойтись без покупных увлажнителей воздуха. Достаточно будет обеспечить растению каждодневное систематическое увлажнение листвы из пульверизатора. По мнению опытных цветоводов, так как кариота очень крупная, то установка глубокого поддона с влажным керамзитом в этом случае неэффективна. Помимо регулярных увлажнений из опрыскивателя, растение очень хорошо реагирует на такую гигиеническую процедуру, как регулярное протирание листвы увлажненной мягкой губкой.
Для увлажнения как листвы, так и субстрата в емкости нужно использовать хорошо отстоявшуюся и мягкую воду. Также важна и температура воды, которая может варьироваться от 20 до 25 градусов.
Удобрение
Подкормки проводят только в весеннее и летнее время. Вносить удобрения в субстрат следует с частотой 2 или 3 раза в месяц. К выбору подходящей для кариоты питательной смеси нужно отнестись с большой ответственностью. Для этого растения рекомендуется приобрести комплексное минеральное удобрение для пальм. При этом универсальный минеральный комплекс для него не подходит. Такой пальме нужно постараться обеспечить баланс питательных веществ в почвосмеси, а еще для нее имеет большое значение содержание в субстрате микроудобрений.
Для кариоты представляют одинаковую ценность все микроэлементы: фтор, азот, марганец, бор, кальций, медь и др. Как нехватка, так и избыток этих веществ может крайне негативно отразится на состоянии и развитии растения. В связи с этим для него рекомендуется использовать удобрения специально предназначенные для пальм, так как они обладают оптимальным составом идеально подходящим для такого растения.
В зимнее и осеннее время подкормки не проводят. Для этой пальмы нельзя использовать удобрения длительного действия, а также она плохо реагирует на внекорневые подкормки (по листу).
Для этой пальмы нельзя использовать удобрения длительного действия, а также она плохо реагирует на внекорневые подкормки (по листу).
Выбор почвосмеси и горшка
Для посадки и пересадки такой высокодекоративной пальмы можно использовать любую универсальную почвосмесь для комнатных культур высокого качества. Она не предъявляет особых требований к составу субстрата, лишь бы он был хорошо дренированным и рыхлым. Лучше всего для выращивания комнатной кариоты подходит готовая землесмесь для пальм, однако так же можно использовать и универсальный субстрат. При желании почвосмесь можно сделать своими руками, для этого соедините песок, компост, дерновую почву и перегной, которые берут в равных долях.
С большой внимательностью следует отнестись к выбору подходящего горшка для посадки такой пальмы. Для этого рекомендуется выбрать контейнер, ширина которого меньше, чем высота. И это даже с учетом того, что многоствольная пальма активно разрастается вширь. Такое растение обладает хорошо развитыми стержневыми корнями, которые залегают на большую глубину. Им необходимо обеспечить доступ к свободному субстрату. Во время пересадки старый контейнер заменяют на новый более крупный, диаметр которого больше примерно на 50 мм.
Им необходимо обеспечить доступ к свободному субстрату. Во время пересадки старый контейнер заменяют на новый более крупный, диаметр которого больше примерно на 50 мм.
Пересадка пальмы кариота
Пересаживают кариоту только тогда, когда это необходимо. Пока растение молодое, средняя частота его пересадки составляет 1 раз в два года. Более взрослые кусты подвергают данной процедуре реже, а точнее, 1 раз в 3 или 4 года.
Пересадку пальмы проводят методом перевалки, при этом постарайтесь не разрушить ком земли. При необходимости можно удалить верхний слой субстрата, если он сильно загрязнен, при этом постарайтесь не травмировать корневую систему. Помните о том, что повреждение корней может стать причиной гибели куста. Во время посадки и пересадки на дне контейнера обязательно делают толстый слой дренажа.
Способы размножения
Размножить пальму кариоту можно семена. При этом многоствольное растение размножают нередко и вегетативным способом.
Деление куста
Размножение делением куста — это наиболее трудоемкий метод. Для этого крутину взрослого сильно разросшегося растения разделяют на несколько частей. Этот метод позволяет получить полноценное взрослое растение, затратив на это совсем немного времени, однако высок риск того, что деленка может погибнуть. Разделение пальмы рекомендуется совместить с пересадкой. В этом случае важно, как можно меньше травмировать корни. А для того чтобы деленки успешно прижились, им обеспечивают максимально благоприятные условия с очень высоким уровнем влажности воздуха.
Для этого крутину взрослого сильно разросшегося растения разделяют на несколько частей. Этот метод позволяет получить полноценное взрослое растение, затратив на это совсем немного времени, однако высок риск того, что деленка может погибнуть. Разделение пальмы рекомендуется совместить с пересадкой. В этом случае важно, как можно меньше травмировать корни. А для того чтобы деленки успешно прижились, им обеспечивают максимально благоприятные условия с очень высоким уровнем влажности воздуха.
Размножение черенками
В этом случае для размножения используют корневые отпрыски. После того как у прикорневой поросли родительского куста сформируется несколько собственных корней, отростки аккуратно отрезают от материнского растения. На укоренение их высаживают в песок и накрывают сверху прозрачным колпаком, обязательно поддерживают оптимальную температуру воздуха — от 20 до 25 градусов. Отпрыск регулярно увлажняют из пульверизатора и защищают от прямых лучей солнца. Когда кустик укоренится его высаживают в отдельный горшок и ухаживают как за взрослой пальмой.
Выращивание из семян
Размножение кариоты семенами показывает низкую эффективность. Это связано с тем, что семенной материал сохраняет хорошую всхожесть короткое время, а еще появление сеянцев придется ждать 1–3 месяца.
Высевают семена в весеннее время. Для этого используют плоский контейнер, имеющий высоту не более 15 сантиметров, наполненный легким субстратом, который предварительно дезинфицируют фунгицидным препаратом. Непосредственно перед высевом семенной материал на протяжении 24 ч выдерживают в растворе стимулятора роста. Высевают семена на глубину 10–15 мм. Сверху посевы накрывают стеклом либо пленкой и убирают в тепло (более 25 градусов). Место должно быть темным. Не забывайте каждый день проветривать посевы.
Когда покажутся первые сеянцы, посевы переносят в место с ярким рассеянным освещением. Обычно пикировку проводят после появления первой настоящей листовой пластины. Пересаживают растеньица очень осторожно, стараясь не дотрагиваться до корешков. Для посадки используют отдельные горшочки, в поперечнике достигающие примерно 50 мм. Молодым растеньицам на протяжении первого года жизни нужно обеспечить одинаковые условия в любое время года. При этом температура воздуха должна быть выше, чем для взрослых пальм.
Для посадки используют отдельные горшочки, в поперечнике достигающие примерно 50 мм. Молодым растеньицам на протяжении первого года жизни нужно обеспечить одинаковые условия в любое время года. При этом температура воздуха должна быть выше, чем для взрослых пальм.
Болезни и вредители кариоты
Домашняя пальма кариота не отличается высокой устойчивостью к болезням и вредителям. Однако чаще всего именно неправильный уход приводит к возникновению проблем. Такое растение наиболее подвержено поражению разнообразными гнилями и пятнистостью, при этом чаще всего на нем селятся паутинные клещи, мучнистые червецы и щитовки. Также пальма может сильно пострадать от некоторых видов увядания, к которым относится фузариоз и фитофтора.
Чтобы спасти растение нужно бороться с болезнями и вредителями комбинированными методами. В первую очередь обеспечьте ему правильный уход и оптимальные условия для роста. При необходимости обмойте листовые пластины раствором мыла, используйте различные народные средства, в крайнем случае срежьте пораженные части куста. А также кариоту нужно обработать подходящим фунгицидным или инсектицидным препаратом.
А также кариоту нужно обработать подходящим фунгицидным или инсектицидным препаратом.
Возможные проблемы
- Утрата листвой декоративности из-за нарушения баланса микроэлементов: нехватка цинка — на листовых пластинах образуются некротические пятнышки; нехватка марганца — листва вырастает более мелкая с признаками хлороза и некротическими полосками; недостаток калия — проявляется курчавостью листьев, они засыхают, желтеют, а также образуются полупрозрачные розовые пятнышки; нехватка азота — листва становится блеклой; избыток меди, фтора либо бора — верхушки листовых пластин становятся бурыми и отмирают; дефицит магния — развитие хлороза и др.
- Листва желтеет и облетает. Чрезмерно скудное увлажнение субстрата.
- Образование темных листовых пластин. Застой влаги в субстрате.
- Курчавость листвы, а также образование пятнышек коричневого и желтоватого оттенка. Чрезмерно яркое освещение.

- Хлороз на молодых листовых пластинах. Нехватка питательных веществ.
- Куст растет очень медленно, а нижняя листва становится белой. Скудное освещение в сочетании с чрезмерно низкой температурой воздуха.
- Листва становится темной и засыхает. Воздействие сквозняка или в комнате слишком холодно.
- Засыхают верхушки листовых пластин. Очень низкая влажность воздуха.
- Листва утрачивает свой тургор и обвисает. Скудный или слишком редкий полив.
Почему ЧЕРНЕЮТ ЛИСТЬЯ у пальмы комнатной ✔️ Уход за пальмой Дома
Watch this video on YouTube
Виды пальмы кариота с фото
Кариота (Caryota) представляет собой кустистую пальму, которая не отличается особым разнообразием видов. У подобных пальм, растущих в природных условиях, наблюдается склонность к спонтанному скрещиванию разнообразных видов меж собой. Благодаря этому понять, какой именно вид кариоты вы обнаружили в дикой природе, нередко бывает довольно затруднительно. Несмотря на это, у данной пальмы имеется несколько десятков видов, которые однако очень похожи меж собой. Именно поэтому видовые названия и характерные признаки не имеют существенного значения. При этом стоит отметить, что всем видам и разновидностям требуются схожие условия для правильно роста и развития.
Несмотря на это, у данной пальмы имеется несколько десятков видов, которые однако очень похожи меж собой. Именно поэтому видовые названия и характерные признаки не имеют существенного значения. При этом стоит отметить, что всем видам и разновидностям требуются схожие условия для правильно роста и развития.
Комнатная кариота значительно отличается от своих дикорастущих собратьев тем, что в культуре распространенно всего лишь два вида, которые с легкостью можно отличить друг от друга:
Кариота нежная, или мягкая (Caryota mitis)
Этот многоствольный куст в природных условиях может иметь высоту около 9 метров. В домашних условиях его высота, как правило, не превышает 150 сантиметров. При этом такие кусты с течением времени не утрачивают свою способность разрастаться, причем чаще всего они увеличиваются вширь. Так как куст состоит из нескольких стеблей, то его можно с легкостью размножить делением. Большие неравномерно-клиновидные листовые пластины включают в свой состав ассиметричные доли с зубчатой кромкой, при этом их верхняя часть рассечена больше чем наполовину. Ширина листовых пластин треугольной формы около 12 сантиметров, при этом их длина лишь немного больше. Длина довольно изящных черенков может варьироваться от 0,3 до 0,5 метров. Длина стержня соцветия доходит до 0,6 метров, при этом округлые плоды красного цвета в поперечнике достигают примерно 10 мм.
Ширина листовых пластин треугольной формы около 12 сантиметров, при этом их длина лишь немного больше. Длина довольно изящных черенков может варьироваться от 0,3 до 0,5 метров. Длина стержня соцветия доходит до 0,6 метров, при этом округлые плоды красного цвета в поперечнике достигают примерно 10 мм.
Кариота жгучая, или Винная пальма (Caryota urens)
Этот вид является одноствольным. Его листовые пластины состоят из ассиметричных долек, имеющих форму треугольника. Их верхушка рассечена так же, как и у предыдущего вида, а еще они немного уже. Мощные крупные многоцветковые соцветия свисают вниз, в природных условиях их длина может доходить до нескольких метров. Плоды красные, но имеют больший размер по сравнению с кариотой нежной.
Кариота (Рыбий хвост) Caryota
Семейство арековых (пальмы). Родина Индия, Индокитай, Азия, острова Малайского архипелага. Род Кариота включает 14 видов. Особенности рода — монокарпическое развитие — эти пальмы цветут и плодоносят один раз в жизни, затем погибают. В среднем жизненный цикл кариоты составляет не более 20 лет, продолжительность цветения зависит от количества соцветий и плодов. Редкие экземпляры живут до 25 лет.
В среднем жизненный цикл кариоты составляет не более 20 лет, продолжительность цветения зависит от количества соцветий и плодов. Редкие экземпляры живут до 25 лет.
- Кариота жгучая Caryota urens — или Винная пальма — иногда выращивается в горшках и кадках — это скорее не домашнее, а оранжерейное растение. Стволы этой пальмы используются в качестве строительного материала, из сердцевины ствола получают сахар, вино, и саго (крупа из крахмала пальмы). Пальма растет в один ствол, в природе достигает 12-13 м в высоту, обхват ствола взрослой пальмы 30-35 см в диаметре. Ваи 5-6 м длиной и около 4 м в ширину, доли листьев неправильно-треугольной формы, каждая 15 см длиной и 7-9 см шириной, на вершине лист рассечен глубокой выемкой примерно до середины. Размеры пальмы в домашних условиях составляют примерно 1,5 м в высоту, вверху размах кроны около 80-90 см. Вообще растет кариота пучком, ведь в горшке мы видим не ствол, а несколько черешков листьев, но своей полной длины, как у дикорастущих экземпляров в 4-5 м они не достигают.

- Кариота мягкая Caryota mitis — или пальма «рыбий хвост», давно завоевала цветочные рынки и подоконники наших квартир. Листья дважды-рассечено-перистые, каждый сегмент имеет неглубоко рваные края, традиционная форма рыбьего хвоста, серединка длиннее, иногда образует острый клин. В домашних условиях эта пальма обычно не превышает 1,5 метров, в природе — 8-9 м, причем вся растительность на макушке, ствол несет на себе остатки старых усохших листьев. В молодом возрасте пальмы по форме образуют кустарник, а не дерево, т.е. растет не в один ствол, а образует множество корневых отпрысков и достаточно густой куст.
- Кариота тупая Caryota obtusa (синоним Кариота гигантская Caryota gigas) — вид родом из северо-восточной Индии и Северного Таиланда, растет высоко в горах (от 1000 до 1500 м над уровнем моря). В качестве домашнего растения стала выращиваться относительно недавно. После посева семян (они быстро прорастают), за год достигает 80-90 см.
 Эта пальма отличается гигантскими размерами (13-15 м в высоту), а ствол до 75 см в диаметре. Имеет чрезвычайно плотную древесину, которую сложно пилить даже хорошими пилами. Но для нас это не принципиально — декоративность кариоты тупой в листьях — дважды-перистые ваи состоят из множества листочков, которые имеют форму веера, с волнистым краем. Черешки листьев покрыты черными волокнами, т.е. растет почти черный ствол. Кстати, плоды этой пальмы очень раздражающие и токсичные (содержат оксалаты). Этот вид легко спутать с кариотой мягкой, главное отличие — в строение сегментов листьев: у кариоты мягкой треугольные волнистые листочки образуют по середине острый угол, клин, а у кариоты тупой листочки по форме с ровным, несколько скошенным краем, верхний сегмент листа рассечен, у молодого листа образует практически круг.
Эта пальма отличается гигантскими размерами (13-15 м в высоту), а ствол до 75 см в диаметре. Имеет чрезвычайно плотную древесину, которую сложно пилить даже хорошими пилами. Но для нас это не принципиально — декоративность кариоты тупой в листьях — дважды-перистые ваи состоят из множества листочков, которые имеют форму веера, с волнистым краем. Черешки листьев покрыты черными волокнами, т.е. растет почти черный ствол. Кстати, плоды этой пальмы очень раздражающие и токсичные (содержат оксалаты). Этот вид легко спутать с кариотой мягкой, главное отличие — в строение сегментов листьев: у кариоты мягкой треугольные волнистые листочки образуют по середине острый угол, клин, а у кариоты тупой листочки по форме с ровным, несколько скошенным краем, верхний сегмент листа рассечен, у молодого листа образует практически круг.
В домашних условиях кариота может цвести, если достаточно места, света, не слишком жарко (зимой прохладно) и много свежего воздуха. При этом цветение горшечной кариоты продолжается в среднем 1 год, после чего пальма быстро усыхает и погибает.
Уход за Кариотой
Температура: умеренная в течение всего года, оптимальная температура летом 18-22°С, желательно не выше 24°С (в жаркие дни перенесите горшок в прохладное место, например, составьте с подоконника на пол). Зимний минимум для кариоты в горшке +13°С, однако, если вы опытный цветовод, то вполне можете оставлять кариоту в утепленном горшке на балконе, до минимальной температуры в +3°С (без полива, горшок в поролоне или ведре с опилками). Если пальма все же растет при более высоких температурах, в комнате с центральным отоплением, то ее необходимо
опрыскивать и защищать от жаркого воздуха батарей. В идеале, ваша пальма будет счастливее летом в саду, а зимой на утепленном балконе или зимнем саду.
Освещение: светлое место, Кариоту нужно притенять от солнечных лучей (она боится не ожогов, а жары). Но не стоит размещать эту пальму в затененном месте — она не настолько теневынослива. Зимой освещение должно быть очень хорошим, если необходимо, поставьте рядом с пальмой лампу дневного света (люминесцентную или светодиодную).
Полив: частота полива кариоты, зависит от температуры, при которой растение содержится. Но, в общем, полив должен быть равномерный, весной и летом обильный, после просушки верхнего слоя земли. Осенью и зимой полив умеренный, земля обязательно должна успевать высыхать полностью. При холодной зимовке около 5-15°С увеличиваются периоды сухого содержания — пальма тем дольше остается сухой, чем ниже температура.
Удобрение: проводят с мая по сентябрь еженедельно, специальным удобрением для пальм или любым жидким удобрением для комнатных растений.
Влажность воздуха: Кариота любит влажный воздух, поэтому не плохо её опрыскивать ее утром и вечером, если влажность воздуха ниже 50%. Особенно это важно, если кариота содержится в комнате с центральным отоплением, при влажность ниже 40% поставьте увлажнитель воздуха.
Пересадка: пальма очень не любит пересадку, поэтому пересаживают только тогда, когда корни заполнят весь горшок или кадку, и начинают вылезать за пределы емкости, т. е. примерно через 2-3 года — молодые растения, через несколько лет — старые. Почва — 2 части легкой дерновой, 2 части перегнойной, 1 часть торфяной, 2 части мелкого гравия (фракция 2-3 мм), немного древесного угля. На дно ведра или кадки дренаж не менее 5 см. При пересадке пройдитесь ножом по краю горшка, чтобы отделить земляной ком от его стенок и меньше травмировать корни. При посадке не утрамбовывайте землю руками — она постепенно осядет от поливов, и можно будет досыпать свежей земли.
е. примерно через 2-3 года — молодые растения, через несколько лет — старые. Почва — 2 части легкой дерновой, 2 части перегнойной, 1 часть торфяной, 2 части мелкого гравия (фракция 2-3 мм), немного древесного угля. На дно ведра или кадки дренаж не менее 5 см. При пересадке пройдитесь ножом по краю горшка, чтобы отделить земляной ком от его стенок и меньше травмировать корни. При посадке не утрамбовывайте землю руками — она постепенно осядет от поливов, и можно будет досыпать свежей земли.
Размножение кариоты семенами
В магазинах семян можно приобрести семена пальмы кариота и вырастить её у себя на подоконнике. При покупке семян обратите внимание на дату – семена кариоты сильно теряют всхожесть уже через 2-3 месяца хранения.
Сеять лучше в конце февраля. Можно посеять в торфяные горшочки или сразу в отдельные горшочки диаметром 8-10 см. Подготовьте грунт: 2 части листовой земли, 1 часть дерновой, 1 часть вермикулита. Стерилизуйте его в микроволновке или духовке.
Семена кариоты очень плотные, жесткие, их необходимо надпилить с помощью пилки для ногтей. Но делайте это аккуратно, чтобы истончить слой оболочки семя, но не повредить ядро. Затем замочите семена на пару дней в воде комнатной температуры, желательно добавить стимулятор роста (например, циркон или проросток).
Но делайте это аккуратно, чтобы истончить слой оболочки семя, но не повредить ядро. Затем замочите семена на пару дней в воде комнатной температуры, желательно добавить стимулятор роста (например, циркон или проросток).
Семена пальмы кариоты заделывайте на глубину 1,5-2 см, увлажните грунт и поставьте в теплое место. Желательно использовать подогрев, чтобы температура было 28-30°С – можно поставить горшочки или плошку с семенами на батарею, можно на электрогрелку или использовать сушилку для обуви. Внимание – следите, чтобы вода не попала на электроприбор!
Ждать появления всходов придется долго – в среднем месяц, возможно, до трёх месяцев.
Когда семена прорастут, переставьте их на светлое место, с притенением с 12 до 15 часов дня в солнечные часы. Поливайте умерено – переувлажнение губительно для сеянцев пальмы, как и пересушка. Первую неделю держите в тепле, но постепенно понижайте температуру до 22-24°С.
Подробнее о культуре и выращивании пальм см. Пальмы
Секреты ухода
Чтобы избежать переувлажнения грунта, не сажайте пальму в слишком большой горшок — земля будет закисать, плохо усваиваются питательные элементы, листья желтеют, корни загнивают.
Эта кариота пострадала от мороза, несмотря на то, что в природе температура в горах опускается очень низко, температура ниже +5°С может привести к переохлаждению корней, а ниже 0°С — к обморожению листьев.
При пересадке добавьте в землю разрыхлитель — вермикулит, можно кусочки сосновой коры, кокосовое волокно.
Пальма кариота в домашних условиях растет энергично и достигает около 1 м высотой. Такому растению требуется питательный грунт, обычная земля для пальм (из магазина) состоит в основном из торфа и не очень годится, по большому счету.
Добавьте в землю при пересадке дерновую землю или хорошо перепревший компост. После пересадки не подкармливайте, по меньшей мере, 1,5-2 месяца.
Клещ на пальме
Паутинный клещ – появляется на комнатных цветах в любое время года, заносится с ветром или другими растениями. Вначале на листьях появляются небольшие обесцвеченные пятна, если посмотреть на просвет листа, видны точечные проколы. Постепенно листья желтеют и усыхают. При сильном поражении в междоузлиях и с обратной стороны листьев видна паутина.
При сильном поражении в междоузлиях и с обратной стороны листьев видна паутина.
Меры борьбы: промыть растение в мыльной воде – взбить губкой пену и обтереть каждый лист, или развести мыльный раствор и выполоскать всю крону (прикрыв землю пакетом). Можно оставить мыло на 20-30 минут. Затем сполоснуть листву горячей водой, температура – 40-45 градусов, по ощущениям руке горячо. Лучше использовать зеленое калийное мыло, его продают в цветочных отделах.
Повторить горячий душ через 5-7 дней еще дважды.
Можно использовать такие препараты, как Фитоверм, Актофит, Агравертин, Акарин – из расчета 10 мл на 1 литр воды, либо Вертимек (1 мл на 1 литр воды). Обработку нужно повторить через 3-5 дней – если жаркая или теплая погода (26-24 градусов) и через 7 дней, если температура воздуха 20 градусов и ниже, так как эти препараты не убивают яйца клещей.
Можно чередовать горячий душ и обработку акарицидами.
Очень эффективны препараты Санмайт или Таурус в расчете 1 г на 1 л воды – однократная обработка с тщательным смачиванием кроны уничтожает взрослых вредителей и непитающиеся стадии (яйца).
Пальма кариота — Уход в домашних условиях
Кариота мягкая (нежная) (Caryota mitis)
Пальма кариота легко определяется по характерным раздвоенным листьям с «рваными» краями. Листья этой пальмы по форме похожи на рыбий хвост.
Род включает 12 видов растений, которые произрастают в Индии, Индокитае, Юго-Восточной Азии, а также на Малайских островах.
Интересно, что из сока некоторых пальм этого рода готовят сахар и вино.
В домашних условиях чаще всего выращивается кариота мягкая, или нежная (Caryota mitis).
В природе пальма криота может вырастать до 10 метров и выше.
Если за кариотой хорошо ухаживать, то она и в домашних условиях довольно быстро растет. Пальма может вырасти до 2,5 метров за несколько лет. Но если вам не нужно высокое растение, то рост кариоты можно ограничить, пересаживая ее только в том случае, если корни уже вылезают из горшка.
Еще один вид, но менее распространенный кариота жгучая (Caryota urens), которая получила такое название благодаря солям щавелевой кислоты, содержащимся в плодах этой пальмы. Кариота жгучая имеет листья треугольной формы. В высоту этот вид пальмы также может вырастать до 2,5 м. Другое название пальмы -кариота винная.
Кариота жгучая имеет листья треугольной формы. В высоту этот вид пальмы также может вырастать до 2,5 м. Другое название пальмы -кариота винная.
Пальма кариота, уход в домашних условиях.
Температура в течение всего года должна поддерживаться на уровне 14-18°С, так как для хорошего самочувствия кариоте требуется умеренная температура, даже в летний период нужно стараться сделать так, чтобы она не поднималась выше 18°С. Если же температура выше 18 градусов, то необходимо увеличить частоту опрыскивания. В зимний период температура не должна опускаться ниже 13°С.
Освещение умеренно яркое. Не смотря на то, что кариоте требуется много света, активные прямые солнечные лучи способны ей навредить. Лучше всего держать пальму у «юго-западного» или «юго-восточного» окна. В зимний период освещение должно также быть довольно ярким.
Полив кариоты весной и летом должен быть обильным, но не следует допускать избыток влаги в горшке с растением. Зимой пальму поливают умеренно, а земля в горшке должна быть чуть-чуть влажной.
Листья кариоты следует опрыскивать теплой мягкой отстоявшейся водой. Если комнатное растение стоит рядом с источниками отопления, то его можно опрыскивать 2 раза в день — утром и вечером. Зимой кариоту опрыскивают пореже.
Почву для выращивания кариоты нужно выбирать слабокислую или нейтральную. Почвенная смесь должна состоять из глинисто-дерновой земли и перегнойно-листовой земли в соотношении 1:1 с добавлением торфа, перепревшего навоза и песка. Также можно использовать готовую почвенную смесь, предназначенную для пальм.
Подкормка кариоты производится с мая по сентябрь раз в две-четыре недели. Можно использовать удобрение, специально предназначенное для пальм.
Пересаживать кариоту нужно как можно реже, поскольку она, как и большинство пальм, плохо переносит пересадку. Пересадка кариоты осуществляется только тогда, когда горшок стал явно мал для растения.
Размножение кариоты происходит семенами, которые сажают на глубину около 1 см во влажную теплую землю, после чего ее прикрывают стеклом или полиэтиленом, а снимают только через 2-3 месяца. Окрепшие сеянцы кариоты рассаживают по отдельным горшочкам.
Окрепшие сеянцы кариоты рассаживают по отдельным горшочкам.
Цветение кариоты, как правило, в домашних условиях не происходит.
Кариота мягкая, или нежная (Caryota mitis)
Болезни и вредители кариоты.
Листья кариоты желтеют, если растение недостаточно поливается. Следует увеличить интенсивность полива, при этом необходимо следить чтобы в горшке не было избытка влаги.
Также листья пальмы желтеют от недостатка питательных веществ. В этом случае нужно произвести дополнительную подкормку.
У кариоты кончики листьев коричневые. Это последствия избытка влаги, необходимо уменьшить полив, проверить дренаж, и перед следующим поливом дать почве подсохнуть.
Светлые сухие пятна на листьях кариоты появляются от избытка света. В этой ситуации следует переставить горшок в полутень.
Листья кариоты темнеют и вянут от слишком низкой температуры в помещении. Соблюдайте температурный режим, рекомендуемый для этой пальмы.
Вредители кариоты — щитовки, паутинные клещи, мучнистые червецы.
Читайте: комнатный каштан — Кастаноспермум.
Кариота мягкая форма Variegata (Caryota mitis)
Интересное на сайте:
Кариота
Глядя на взрослую кариоту, в её принадлежности к семейству арековых (пальмовых) сомневаться не приходится.
Но таких листьев, как у неё, действительно, больше не встретишь ни у одной из пальм, входящих в это довольно многочисленное семейство. У одних видов пальм листья, как известно, веерные, у других – перистые, и только у кариоты они дваждыперистые. То есть каждый лист состоит как будто из нескольких одноперистых листов, которые попарно крепятся к главной центральной жилке, называемой рахис. Форма перьев таких листьев чаще всего треугольная с неровными краями, похожа на веер, раскрытый не полностью, а кому-то напоминает рыбьи плавники. Отсюда и народное название самого распространённого из видов – пальма «Рыбий хвост».
Размеры таких рыбьих хвостов поистине исполинские – в естественных условиях произрастания могут достигать 5–7 метров, но в культуре, конечно, будут меньше: 1–3 метра. Максимальная высота пальм из этого рода более 20 метров, но есть и низкорослые виды.
Максимальная высота пальм из этого рода более 20 метров, но есть и низкорослые виды.
Цветёт кариота оригинальными длинными свисающими соцветиями, состоящими из женских и мужских цветков, самой разнообразной окраски – от бледно-кремовых, до золотистых и ярко-пурпурных. Плоды – мясистые ягоды голубоватые, красные или почти чёрные. У некоторых видов они содержат жгучие оксалаты, а надрезая соцветия можно собирать густой сахаристый сок, из которого получают сахар или делают пальмовое вино.
По продолжительности цветения кариоте нет равных. Но происходит оно всего раз в жизни и может продолжаться 5–7 лет. Первое, похожее на косичку соцветие, появляется из пазухи самого верхнего листа, а затем и из других, ниже расположенных, и даже из углов уже опавших листьев. В самый разгар цветения пучок таких соцветий похож на пышный конский хвост. После того как на последнем соцветии завязываются плоды, одноствольная пальма погибает. Но некоторые виды бывают многоствольными.
Распространённые виды кариоты
К роду Кариота относятся около 12 видов пальм, которые представлены как очень высокорослыми экземплярами, так и почти кустарниковыми формами. К тому же в диких условиях они легко скрещиваются между собой. В некоторых южных странах, например, полуострова Индостан и на Цейлоне, растение разводят искусственно. Помимо сахара и пальмового вина отдельные виды могут служить источником очень качественной, прочной и твёрдой древесины, а листья используются для изготовления рогожи, канатов, корзин, конопаточного материала.
К тому же в диких условиях они легко скрещиваются между собой. В некоторых южных странах, например, полуострова Индостан и на Цейлоне, растение разводят искусственно. Помимо сахара и пальмового вина отдельные виды могут служить источником очень качественной, прочной и твёрдой древесины, а листья используются для изготовления рогожи, канатов, корзин, конопаточного материала.
В культуре кариота встречается пока ещё нечасто и в основном представлена двумя наиболее популярными видами.
Нежная, или мягкая — именно её чаще всего можно встретить в продаже под названием «Рыбий хвост». В естественных условиях, это пальма высотой 5–10 м, состоящая из нескольких близкорасположенных друг к другу стволов диаметром 8–12 см. В комнатной культуре обычно выращивают только молодые, пока ещё одноствольные экземпляры, высотой до 2,5 м. Листья у кариоты нежной крупные поникающие, длиной от 1,2 до 3 м. Отдельные доли сложного листа неравномерные, клиновидной формы, длиной до 15 см, шириной 12 см, по краям зубчатые, а на вершине глубоко рассечённые. Черешок до 60 см длиной. Окраска листьев тёмно-зелёная, с обратной стороны более светлая. Но есть и вариегатные формы – с продольными светлыми полосами на листьях. Соцветия состоят из мелких бело-розовых цветков. В длину достигают 30–60 см. Плоды красные округлые, около 1,5 см в диаметре, но в домашней культуре цветения и плодоношения обычно не происходит.
Черешок до 60 см длиной. Окраска листьев тёмно-зелёная, с обратной стороны более светлая. Но есть и вариегатные формы – с продольными светлыми полосами на листьях. Соцветия состоят из мелких бело-розовых цветков. В длину достигают 30–60 см. Плоды красные округлые, около 1,5 см в диаметре, но в домашней культуре цветения и плодоношения обычно не происходит.
Жгучая — относится к одноствольным пальмам с крепким прямым стволом высотой 12-18 м и до 45 см в диаметре. Листья очень крупные — до 6 м длиной и 4 м в размахе. Доли – неправильной треугольной формы – до 15 см в длину и около 10 см в ширину. Рассечение неравномерное, до половины доли. Плоды – красные ягоды, диаметром около 1,5 см. В них содержатся соли щавелевой кислоты (оксалаты кальция), вызывающие раздражение при попадании на кожу и слизистые оболочки. Соцветия кремовые, длиной 3-4 м. Из них в большом количестве добывают сок, идущий на вино и крепкий алкогольный напиток тодди. Поэтому есть ещё одно название этого вида – Кариота винная. Кроме того, в стволах взрослых деревьев накапливается много крахмала, идущего на изготовление крупы саго, а из листовых черешков получают очень крепкое волокно под названием «китуль». Ареал распространения этого вида пальмы, в том числе и культивируемой в практических целях, — Индия, Бирма, Таиланд и Малайзия.
Кроме того, в стволах взрослых деревьев накапливается много крахмала, идущего на изготовление крупы саго, а из листовых черешков получают очень крепкое волокно под названием «китуль». Ареал распространения этого вида пальмы, в том числе и культивируемой в практических целях, — Индия, Бирма, Таиланд и Малайзия.
Полосатая — это пальма высотой до 15 м с одиночным стволом, который по мере роста увеличивается до 40 см в диаметре и покрывается трещинами. Листья плотные, кожистые с возрастом темнеют и становятся почти чёрными. Длина отдельного листа 5–7 м, а ширина – до 1,5 м. Соцветия длиной до 2,5 м, плоды чёрные. У молодых пальм черешки покрыты узором из тёмных и светлых полос, что и дало название этому виду. Ареал распространения – горные леса Папуа-Новой Гвинеи.
Змеекожая — очень редко встречающийся вид пальм, имеющий к тому же очень ограниченный ареал распространения – острова республики Вануату. Пожалуй, это единственная пальма, которая культивируется у себя на родине исключительно в декоративных целях. Черешки её листьев в самом деле покрыты узором, похожим на змеиную кожу. Форма листьев в отличие от многих других кариот более аккуратна, что в целом придает растению более опрятный и привлекательный вид. Из-за невысокого роста – 7-8 метров в естественных условиях – подходит для выращивания в закрытых помещениях.
Черешки её листьев в самом деле покрыты узором, похожим на змеиную кожу. Форма листьев в отличие от многих других кариот более аккуратна, что в целом придает растению более опрятный и привлекательный вид. Из-за невысокого роста – 7-8 метров в естественных условиях – подходит для выращивания в закрытых помещениях.
Большая — одна из самых крупных и высокорослых пальм этого рода, в высоту достигает более 30 м. Произрастает во Вьетнаме и Таиланде, Лаосе и Мьянме, на юге Китая, островах Ява и Суматре. Ствол одиночный, ровный и гладкий, с отметинами опавших листьев, служит источником высококачественной древесины. Листья зелёные поникающие, до 5 м длиной, соцветия – до 1,5 м. Плоды около 2,5 см в диаметре. Из-за крупных размеров в культуре выращивается этот вид только под открытым небом в странах с тёплым климатом. Как и все одноствольные кариоты, после плодоношения погибает.
Уход и выращивание кариоты
Готовый почвогрунт, предназначенный для пальм, может оказаться недостаточно питательным для кариоты. Оптимальной будет почвосмесь в следующем составе: по две части дерновой земли (лёгкой глинистой) и листовой, и по одной части перегноя, торфа и песка.
Оптимальной будет почвосмесь в следующем составе: по две части дерновой земли (лёгкой глинистой) и листовой, и по одной части перегноя, торфа и песка.
Горшки подбирают специальные – пальмовые, они глубже, чем обычные. На дно – до 2/3 объёма – насыпается дренажный материал с добавлением кусочков древесного угля, что предотвратит загнивание корней. Нельзя высаживать маленькое растение сразу в большую ёмкость. Если корневая система будет намного меньше земляного кома, произойдёт его закисание и уплотнение, нарушится воздухопроницаемость, растение в таком горшке будет чувствовать себя угнетённо и перестанет расти.
Для выращивания кариоты необходимо хорошее освещение. Но с небольшим дефицитом света она мирится легче, чем с его избытком. При чересчур интенсивном освещении растение нужно притенять и защищать почву от перегрева. Весной и летом температура в помещении должна быть в пределах 22-25 градусов тепла, зимой может быть меньше – до +18 градусов. Период покоя её естественным жизненным циклом не предусмотрен. Однако в условиях умеренных широт, если нет дополнительного искусственного освещения, с октября по февраль происходит вынужденная приостановка в развитии. В этот период можно ограничить число поливов и обойтись без подкормок.
Однако в условиях умеренных широт, если нет дополнительного искусственного освещения, с октября по февраль происходит вынужденная приостановка в развитии. В этот период можно ограничить число поливов и обойтись без подкормок.
Как все выходцы из тропиков, кариота любит обильные поливы и повышенную влажность воздуха. Причём чем выше температура окружающего воздуха, тем в большем количестве влаги она нуждается. В период активной вегетации почва даже на поверхности пересыхать не должна, однако излишки из поддона желательно сливать после каждого полива. В период вынужденного покоя можно допускать подсыхание на глубину до 1,5 см. Для создания влажного микроклимата очень полезен частый интенсивный тёплый душ или протирание листьев влажной губкой. Воду при этом используют только мягкую, отстоявшуюся.
Кариота очень отзывчива на подкормки, в качестве которых подойдут универсальные жидкие удобрения или специально предназначенные для пальмовых. Корневые подкормки можно чередовать с внекорневыми. Но для последних, концентрацию обычно берут в половинной дозе. Частота подкормок – раз в 2-4 недели.
Но для последних, концентрацию обычно берут в половинной дозе. Частота подкормок – раз в 2-4 недели.
Растение болезненно переносит пересадку. Поэтому взрослые экземпляры обычно пересаживают не чаще одного раза в три года — методом перевалки или ежегодно меняют верхний почвенный слой. Если пальма приобретена в магазине, то первый раз её необходимо пересадить через две – три недели после покупки. А в остальных случаях лучшее время для этого – ранняя весна.
Размножение кариоты
Многоствольные пальмы, такие, например, как кариота нежная, можно размножать с помощью корневых отпрысков, а одноствольные – только семенами. Причём процесс этот достаточно кропотливый. Семена очень быстро теряют всхожесть, поэтому при покупке обязательно нужно обращать внимание на срок годности. Посев проводят весной в грунт примерно такого же состава, как и для взрослых пальм, или же увеличивают в нём долю песка и торфа. Глубина контейнера – не больше 15 см, чтобы не развивался слишком длинный корень.
Перед посевом семена в течение суток рекомендуется подержать в растворе стимулятора. Заделывают их на глубину 1,5–2 см и накрывают сверху стеклом или плёнкой. Оптимальная температура для прорастания 25-28 градусов тепла, желателен нижний подогрев. Не реже 2–3 раз в неделю такую мини-тепличку нужно проветривать. Всходы появляются обычно неравномерно через 1-3 месяца после посева. Пересадку их в маленькие – 5–7 см в диаметре горшочки, осуществляют, как только появится первый настоящий листочек. Для успешного роста сеянцев температура в помещении должна быть выше на 2-3 градуса, чем при выращивании взрослых пальм.
Болезни и вредители
Наиболее опасны такие погрешности в содержании, как сухой воздух в помещении и прямой солнечный свет. При этом её листья истончаются, кончики становятся сухими, а от солнечных ожогов на них появляются светлые пятна. Недостаток в почве влаги и питательных веществ приводит к пожелтению и даже опадению листьев, а при слишком низкой температуре они темнеют и вянут.
Типичные вредители кариоты, характерны и для других видов пальм — это щитовка, паутинный клещ, червецы. При излишнем поливе в почве заводятся грибные комарики, которые поедают корни. Если воздух в помещении слишком сухой, может также поселиться красный паутинный клещ, которого легко распознать по мелким красным точкам на обратной стороне листьев. Для борьбы с этим серьезным вредителем практически всех комнатных цветов чаще всего применяют опрыскивание мыльным раствором, приготовленным из специального зелёного или обычного хозяйственного мыла. Молодые растения обычно погружают в него полностью, предварительно защитив от намокания земляной ком.
Кариота в фотографиях
Пальма кариота – уход в домашних условиях. Выращивание кариоты, пересадка и размножение. Описание, виды. Фото
Кариота (Caryota) – это целая группа пальм, которые относятся к семейству Арековых и встречаются в Австралии и многих Азиатских странах, на Филиппинских островах и в Новой Гвинее. Эти своеобразные пальмы отличаются необычной формой листьев и оригинальным цветением. Декоративное вечнозеленое растение насчитывает в своем семействе пальмы различных форм и размеров. Они могут быть в виде высоких деревьев, с одиночным стволом, который достигает до 25 метров в высоту. Встречаются и пальмы в виде небольших кустарников, которые растут плотно друг к другу и выглядят как живая изгородь.
Эти своеобразные пальмы отличаются необычной формой листьев и оригинальным цветением. Декоративное вечнозеленое растение насчитывает в своем семействе пальмы различных форм и размеров. Они могут быть в виде высоких деревьев, с одиночным стволом, который достигает до 25 метров в высоту. Встречаются и пальмы в виде небольших кустарников, которые растут плотно друг к другу и выглядят как живая изгородь.
Кариота цветет только один раз, но довольно продолжительный период. Обычно этот период наступает в десятилетнем возрасте и может продолжаться более пяти лет подряд. Цветет пальма большими соцветиями, состоящими из висящих веточек с маленькими цветками. Когда в нижней части пальмы еще продолжается цветение, то в верхней уже созревают плоды. После созревания всех плодов ствол растения погибает.
Уход за пальмой кариота в домашних условиях
Местоположение и освещение
Пальма кариота не любит тень и прямые солнечные лучи. Недостаток света приведет к замедлению роста растения, а излишне активное солнце воздействует на состояние листовой массы (может высушивать листья) и его корневую часть. Благоприятнее всего кариота себя чувствует при рассеянном освещении. Поэтому, при выращивании растения вблизи окон, выходящих на южную сторону, рекомендуется создать небольшое притенение.
Благоприятнее всего кариота себя чувствует при рассеянном освещении. Поэтому, при выращивании растения вблизи окон, выходящих на южную сторону, рекомендуется создать небольшое притенение.
Температура
Температурный режим для выращивания кариоты в весенние и летние месяцы должен быть в пределах 22-24 градусов тепла, а в остальное время – 18-20 градусов, но не меньше.
Влажность воздуха
Влажность воздуха и температура в помещении связаны между собой. Чем выше температура содержания, тем влажность должна быть выше. В осенне-летний период для кариоты необходимо постоянное опрыскивание и ежедневное протирание листьев влажной тканью или мягкой губкой. Пальма предпочитает повышенную влажность. Воду для опрыскиваний и ухода за листьями нужно использовать только очищенную или отстоянную.
Полив
Такую же отстоянную воду необходимо использовать и для полива пальмы кариоты. Ее температура должна быть близка к 25 градусам. В теплое время года почва должна быть всегда умеренно влажной, нельзя допускать ее подсыхания. А вот в холодное время года, наоборот, почвенная смесь перед поливом должна подсохнуть примерно на 3-4 сантиметра. Объемы поливов в зимний и осенний период значительно уменьшаются, но проводятся регулярно.
А вот в холодное время года, наоборот, почвенная смесь перед поливом должна подсохнуть примерно на 3-4 сантиметра. Объемы поливов в зимний и осенний период значительно уменьшаются, но проводятся регулярно.
Почва
В состав грунтовой смеси для выращивания пальмы кариота должны входить следующие компоненты в одинаковых пропорциях: песок, компост, перегной и дерновая земля в равных пропорциях.
Подкормки и удобрения
Внесение удобрений для кариоты рекомендуется проводить только с марта по сентябрь, не более трех раз в месяц, используя подкормки, предназначенные специально для пальм.
Пересадка
Кариота в первые 5-7 лет пересаживается каждый год, а во взрослом возрасте будет достаточно одной пересадки в три года. Для сохранения корневой части лучше пересаживать пальму способом перевалки. Цветочная емкость для кариоты необходима глубокая с обязательным слоем дренажа на дне горшка
Размножение пальмы кариоты
Размножение отпрысками
Размножение отпрысками возможно тогда, когда на них появляется несколько молодых корешков. Тогда их можно отделить от взрослого растения и отпрыски быстро укоренятся. Молодые растения необходимо на некоторое время до начала укоренения спрятать от солнечного света и провести несколько обильных опрыскиваний. После такой подготовки они быстрее приживутся на новом месте. Для укоренения необходима емкость с песком и тепличные условия содержания.
Тогда их можно отделить от взрослого растения и отпрыски быстро укоренятся. Молодые растения необходимо на некоторое время до начала укоренения спрятать от солнечного света и провести несколько обильных опрыскиваний. После такой подготовки они быстрее приживутся на новом месте. Для укоренения необходима емкость с песком и тепличные условия содержания.
Размножение семенами
Размножение семенами потребует много терпения и настойчивости. Семена могут прорастать в течение одного — трех месяцев, все зависит от их свежести и условий хранения. Почву перед посадкой семян необходимо пролить фунгицидным препаратом, а семена предварительно замочить на сутки в растворе с биостимулятором.
Глубина посадки семян – не больше 2-х сантиметров, высота посадочного контейнера – не больше 15 сантиметров. Емкость сразу же накрывают прозрачной пленкой или стеклом и оставляют в теплом затемненном помещении с температурой воздуха 25-30 градусов тепла. Каждый день стекло нужно снимать для осмотра места посадки и для проветривания.
Как только большая часть семян взойдет, сразу нужно снять накрытие и перенести контейнер в комнату с рассеянным освещением. Пикирование проводится после появления первого полноценного листочка в небольшие по размеру горшочки (не более 5 сантиметров в диаметре).
Болезни и вредители
Среди вредителей наиболее опасны для пальмы щитовка, червец, грибные комары и паутинный клещ. Среди болезней чаще всего встречаются грибковые заболевания (например, пятнистость листьев), корневая гниль.
Увядания, подсыхания, замедление роста и другие проблемы с растением часто возникают по причине неправильного ухода или недостаточного количества определенных питательных элементов в почве.
Распространеннные проблемы при выращивании
- При недостаточном объеме воды или частоте поливов – листья увядают и опускаются вниз.
- При низкой влажности и сухом воздухе в помещении – листья подсыхают на самых кончиках.
- При низкой температуре воздуха в помещении и плохой освещенности – замедляется рост растения, появляются сначала желтые, а потом сухие пятна на листьях.

- При наличии холодных сквозняков и низкой температуре воздуха – листья увядают и меняют ярко-зеленую окраску на более темную.
- При недостатке подкормок и отдельных питательных элементов в почве – желтеют молодые листья.
- При недостатке магния – листья желтеют от краев к середине.
- При излишней насыщенности почвы фтором – листья на кончиках становятся бурого цвета, а затем отмирают.
- При частом применении фунгицидов с содержанием меди – появляются черные пятна на листьях, которые постепенно засыхают.
- При переизбытке бора в поливной воде – на листве появляются пятна коричневого цвета.
- При продолжительном солнечном освещении прямого направления, при попадании прямых солнечных лучей на растение – в летний период листья могут покрыться пятнами желтого или коричневого цвета, а в остальное время года на листве появляются пятна светло-желтого оттенка, а сам лист начинает курчавиться.
- При переизбытке влаги, при повышенных объемах поливной воды – листовая часть начинает темнеть, затем чернеть и начинать загнивать.

- При недостаточных объемах воды при поливах и нерегулярных поливах – происходит подсыхание кончиков листьев в верхней части растения, а в нижней части листья становятся полностью желтого цвета.
- При недостатке азота в почве – рост растения замедляется, а листовая часть становится более светлого зеленого оттенка.
- При недостатке калия в почве – листья покрываются сначала пятнами светло-желтого оттенка или оранжевого, затем светло-коричневого, потом листья начинают подсыхать по краям и курчавиться.
- При недостатке марганца в почве – замедляется рост листовой части, появляются пятна и полоски желто-коричневого оттенка.
- При недостатке цинка в почве – листья покрываются сухими пятнами небольшого размера, но в больших количествах.
Виды пальмы кариоты
В природе пальмы легко скрещиваются и образуют новые виды, поэтому трудно с точностью определить, к какому виду относится данное растение. Чаще всего встречаются два вида пальмы кариота.
Кариота мягкая (Caryota mitis) – эти пальмы имеют несколько высоких стволов (около 10 метров в высоту и в среднем 10 сантиметров в диаметре). Листья у этого вечнозеленого дерева достигают 2,5 метров в длину, а соцветия находятся на ножке-стержне, около 50 сантиметров в длину. Кариота мягкая имеет небольшие плоды красного цвета, примерно 1 сантиметр в диаметре. Когда ствол пальмы отмирает, дерево продолжает расти еще долгое время, так как на нем появляются молодые отростки.
Листья у этого вечнозеленого дерева достигают 2,5 метров в длину, а соцветия находятся на ножке-стержне, около 50 сантиметров в длину. Кариота мягкая имеет небольшие плоды красного цвета, примерно 1 сантиметр в диаметре. Когда ствол пальмы отмирает, дерево продолжает расти еще долгое время, так как на нем появляются молодые отростки.
Кариота жгучая, или Винная пальма (Caryota urens) – это одноствольные пальмы с огромными по размеру листьями. Они достигают 6 метров в длину и 5 метров в ширину. Свисающие соцветия имеют огромное количество мелких цветков и располагаются на трехметровой по длине оси. Цветет растение в течение 5-7 лет, начиная с возраста 12-15 лет. По окончании созревания плодов растение полностью погибает.
Комнатные растения Пальмы
Кариота Мягкая и Жгучая (Caryota). Правила ухода и размножения.
Кариота (Caryota) очень необычная пальма которая может похвалиться оригинальными контурами листьев, пышностью кроны и эффектным видом.
В природе Кариота произрастает в тропической Азии, на островах Ява, Филлипинских, Новой Гвинее, а также в тропической Австралии. Эта оригинальная пальма в природе представлена в различных формах как одиночное растение высотой до 25 метров, так и как небольшие кустистые заросли. Кариоту еще называют «ореховой пальмой», так как в греческого слово Caryota переводится как «орех». В природе встречается более 20 видов, но все они склонны к перекрестному опылению, что значительно усложняет их классификацию.
Кариота относится к растениям, которые цветут единожды. Цвести начинает на 10 году роста, непрерывное цветение продолжается от 5 до 7 лет, после чего растение погибает.
В домашних условиях Кариота тоже может порадовать цветением, но только в том случае если соблюдаются все условия содержания: достаточно места, освещения, соблюден температурный режим и много свежего воздуха. Цветение горшочной Кариоты длится 1 год, после чего растение также быстро погибает.
Виды Кариоты:
- Кариота Мягкая или Нежная (Caryota mitis). Листья этой пальмы очень оригинальны и по форме строения напоминают рыбий плавник, что и отразилось на ее названии – пальма Рыбий хвост. Многоствольная, в природе достигает 9 метров, а в комнатных условиях 1.5 метра.
- Кариота Жгучая или Винная пальма (Caryota urens). Одноствольная, в природе достигает в высоту 12-13 метров. Не считается домашним растением, выращивается только в оранжереях. Стволы этой пальмы используют как строительный материал, а сердцевину для изготовления сахара, вина и крупы (саго).
Об уходе за Кариотой:
Температура: Оптимальная температура для Кариоты летом – это 18-22 ºC, желательно не выше 24 ºC. В особо жаркие дни рекомендуется беречь Кариоту от перегрева, переносить в прохладные места. Зимой температура не должна падать ниже 13 ºC, но, если зима не очень холодная, то Кариоту можно оставлять на балконе в утепленном горшке, в поролоне или в ведре с опилками до минимальной температуры -3 ºC. Если пальма зимует все же в комнатных условиях ее необходимо часто опрыскивать и не ставить рядом с отопительным прибором. В идеале Кариота все же предпочтет летом и зимой находится на балконе.
Если пальма зимует все же в комнатных условиях ее необходимо часто опрыскивать и не ставить рядом с отопительным прибором. В идеале Кариота все же предпочтет летом и зимой находится на балконе.
Освещение: Кариота любит рассеянное освещение и не отличается особой теневыносливостью. При притенении может замедляться рост и теряться декоративность растения. Поэтому предпочтительны западные и восточные окна. Растение необходимо беречь от прямых солнечных лучей и от жары, иначе листья могут получить ожоги. Зимой освещение должно быть очень хорошим, при необходимости используют лампу дневного освещения. Кариота не любит перегрева корней, поэтому желательно чтоб она размещалась на полу или на специальной подставке, для того чтоб освещение падало сверху на листву, но это требование не слишком обязательно.
Полив: Кариота нуждается в регулярном и умеренном поливе. Поливать необходимо мягкой отстоянной водой. Частота полива зависит от температуры содержания. При поливе следует ориентироваться на просыхание земляного кома, земля должна успевать полностью просыхать. Излишки воды с поддона рекомендуется сливать. Летом у пальмы активный рост и повышенная потребность в воде, так как грунт просыхает быстрее. Зимой, при прохладном содержании (5-15 ºC), полив сокращают и увеличивают периоды сухого содержания. Чем ниже температура содержания, тем дольше пальма должны оставаться сухой.
При поливе следует ориентироваться на просыхание земляного кома, земля должна успевать полностью просыхать. Излишки воды с поддона рекомендуется сливать. Летом у пальмы активный рост и повышенная потребность в воде, так как грунт просыхает быстрее. Зимой, при прохладном содержании (5-15 ºC), полив сокращают и увеличивают периоды сухого содержания. Чем ниже температура содержания, тем дольше пальма должны оставаться сухой.
Влажность воздуха: Кариота очень влаголюбивое растение и опрыскивание обязательная часть ухода за ней весь летний период, особенно когда влажность воздуха ниже 50 %. В зимний период, если в помещении сухой воздух опрыскивать необходимо регулярно или ставить увлажнитель воздуха. Для опрыскивания вода должна быть отстоянная или дождевая. Для повышения влажности можно ставить рядом с растениями емкость с водой.
Удобрения: Удобрять необходимо в период активного роста, с весны до осени раз в неделю. Зимой и осенью все подкормки прекращают. Для подкормки можно использовать комплексные удобрения для декоративно лиственных растений, так и специальные удобрения для пальм. Частично можно вносить удобрения через опрыскивание листьев, но очень слабым раствором.
Для подкормки можно использовать комплексные удобрения для декоративно лиственных растений, так и специальные удобрения для пальм. Частично можно вносить удобрения через опрыскивание листьев, но очень слабым раствором.
Почва: Для пальм. Необходим хороший дренаж. В субстрат рекомендуется добавлять перлит, вермикулит, древесный уголь.
Пересадка: Пересаживать Кариоту необходимо по мере роста, когда корни заполнят весь горшок и начнут вылезать. Ориентировочно молодые растения пересаживаются раз в 2-3 года. Пальма не очень любит пересадку поэтому используется метод перевалки с полным сохранением земляного кома для того чтоб избежать травм корней. Не рекомендуется трамбовать землю, она сама осядет после полива и тогда можно будет досыпать новой. У взрослых растений в случае если пересадка не нужна ежегодно необходимо менять верхний слой почвы. Необходим хороший дренаж. Горшок для Кариоты подбирают высокий и не сильно широкий, так как у пальмы глубоко залегающие корни, которые требуют доступ к свободной почве.
Вредители Кариоты. Может поражаться паутинным клещом и мучнистым червецом (они заводится при недостатке влаги) и щитовкой. Для профилактики необходимо применять теплый душ, протирать листья. При переувлажнении может поражаться грибными комариками.
Размножение Кариоты:
Кустовые виды размножают отпрысками. Отделение отпрысков происходит после того, как на нем появятся несколько корней, что обеспечит легкое укоренение. Отпрыски хорошо укоренятся в тепличке при температуре 20-22 ºC. При укоренении необходимо частое опрыскивание.
Самым тяжелым размножением является деление куста сильно разросшихся пальм. В таком случае можно получить несколько экземпляров полноценных растений. При таком размножении необходимо как можно бережно разделить корни растений, используя метод промывки корней теплой водой. После проведения такой процедуры необходимо обеспечить повышенную влажность воздуха для того чтоб ускорить адаптацию растения.
Семенное размножение очень кропотливо, так как семена быстро теряют всхожесть, но подогрев несколько улучшает ситуацию. Но в любом случае прорастание длится от 1 до 3 месяцев. Перед посадкой семена необходимо замочить на сутки в растворе Циркона или любого другого стимулятора. Садят семена на глубину не более 15 см, в легком грунте и устраивают тепличку при помощи пленки и держат при температуре 25-30 ºC. Пленку необходимо раз в день снимать, для того чтоб проветрить. При появлении всходов пленку снимают и ставят ближе к свету, а когда появляются первые листья растения рассаживают. Условия содержания молодых растений должна быть ровная, у них нет периодов покоя, а температура должна быть на несколько градусов выше чем у взрослого растения.
Кариота. Проблемы при выращивании:
- Пожелтение и сухость кончиков листьев обычно случается из-за сухости воздуха.
- Пожелтение листвы происходит при недостаточном поливе.

- Коричневые пятна на листьях появляются при избытке бора. Скорее всего вода для полива содержит много бора.
- Листья обвисают, опускаются при недостаточном поливе.
- Листья вянут и темнеют если пальма содержится на сквозняке и при слишком заниженной температуре.
- Отмирание кончиков листьев происходит при переизбытке фтора, удобрений и засолении почвы.
- Появление желтых или коричневых пятен в летнее время происходит из-за переизбытка освещения.
- Листья курчавятся из-за переизбытка освещения.
- Потемнение листьев и появление признаков загнивания говорит об излишнем поливе.
- Пожелтение нижних листьев и отмирание кончиков говорит о редком поливе.
- Бледнение листвы и остановка в росте говорит о дефиците азота.
Просмотры:
866
Кариота жгучая (Caryota urens) — описание, выращивание, фото
Кариота жгучая (Винная пальма, Китуль-пальма)
Произрастание:
Кариота жгучая (Caryota urens) обитает в Юго-Восточной Азии. Эта пальма произрастает на высоте от 0 до 300 м. над уровнем моря во влажных лесах Индии, Мьянмы, Непала, Шри-Ланки. Обосновались представители вида и в Гималаях на высоте свыше 1500 м.
Эта пальма произрастает на высоте от 0 до 300 м. над уровнем моря во влажных лесах Индии, Мьянмы, Непала, Шри-Ланки. Обосновались представители вида и в Гималаях на высоте свыше 1500 м.
Описание растения:
Величина и тип растения:
Кариота жгучая — быстрорастущее растение. В природе она достигает 18 м. в высоту. В комнатном цветоводстве не превышает 2.5 м. При этом срок ее жизни сравнительно недолог, 20-летний рубеж пальма преодолевает крайне редко.
Ствол:
У Кариоты жгучей один прямостоячий серый ствол с диаметром 30–50 см. После опадания старой листвы на нем остаются отметины — почти правильные окружности.
Листья:
Дваждыперестые листья растения достигают 6 м. в длину при ширине 4.5 м. Листовые пластинки треугольные с неравномерно рассеченной вершиной. Расцветка листвы выдержана в зеленых тонах.
Цветы:
Соцветие свисающее, многоцветковое. Розоватые цветки формируют триады: в центре находится женский, два мужских располагаются по бокам. Для переноса пыльцы требуется помощь насекомых.
Для переноса пыльцы требуется помощь насекомых.
Плоды:
Множественные плоды растения шаровидные, красные костянки, 1–2 см. в диаметре. Каждая содержит одно семя.
Плоды Кариоты жгучей содержат соли щавелевой кислоты, которые вызывают раздражение кожи и слизистых. Именно это качество определило видовое название.
НА ФОТО: Кариота жгучая — монокарпик. В естественной среде на 10-летних пальмах появляются цветки, затем плоды. Плодоношение длится годами, после вызревания последней ягоды растение погибает. При комнатном содержании этот вид не цветет.
Хотя от употребления плодов в пищу пришлось отказаться, всем остальным частям пальмы местные жители нашли применение:
- Из ствола делают настилы, кровлю, перегородки и водостоки.
- Сердцевина поставляет саго.
- Основания листьев дают прочное волокно для изготовления щеток и веревок.
- Надрезанные соцветия выделяют сладкий сок, пригодный для получения сахара и алкоголя.

Агротехника:
В домашних условиях рост Кариоты жгучей замедляется. Каждый год она наращивает всего несколько сантиметров.
Температура:
Кариота жгучая любит тепло и не переносит температур ниже +13°C. Но в очень теплых помещениях нужно повышать влажность воздуха, для чего горшок с пальмой ставят в поддон с влажной галькой или влажным мхом сфагнумом, а само растение опрыскивают. Оптимальная температура весной и летом +16–24°C.
Освещение:
Лучше всего этот вид растет на полном солнце, лучи которого проникают сквозь полупрозрачные жалюзи или шторы.
Полив:
Кариоту жгучую нужно поливать обильно и настолько часто, чтобы почва в горшке была постоянно влажной, но нельзя допускать, чтобы горшок стоял в воде.
Удобрение:
С начала весны до середины осени рекомендуется один раз в месяц вносить жидкое удобрение.
Субстрат:
В качестве субстрата лучше использовать смесь на основе плодородной почвы. Корни Кариоты жгучей любят тесноту, поэтому лучше сажать эту пальму в горшок, который кажется слишком маленьким для нее. На дно горшка для дренажа кладут глиняные черепки, почвенную смесь уплотняют вокруг корней растения, стараясь не повредить их. Каждые два или три года растение пересаживают в горшок на один размер больше.
Корни Кариоты жгучей любят тесноту, поэтому лучше сажать эту пальму в горшок, который кажется слишком маленьким для нее. На дно горшка для дренажа кладут глиняные черепки, почвенную смесь уплотняют вокруг корней растения, стараясь не повредить их. Каждые два или три года растение пересаживают в горшок на один размер больше.
Период покоя:
Растущая в горшке Кариота жгучая не имеет четко выраженных периодов вегетации и покоя. Медленный рост может продолжаться осенью и зимой, но в это время растение поливают реже, верхний слой почвы в промежутках между поливами должен просыхать на 1 см. Температура в зимний период должна быть не ниже +13°C и не выше +21°C.
Размножение:
Кариоту жгучую можно размножить только семенами.
При покупке посадочного материала надо обязательно проверить срок годности. Семена этого вида теряют всхожесть очень быстро.
Лучшее время для высевания — весна. Неглубокую емкость наполняют грунтом для взрослых растений. К субстрату рекомендуется добавить торф и песок.
К субстрату рекомендуется добавить торф и песок.
После суточного замачивания в стимуляторе роста семена заглубляют на 2 см. Сверху накрывают стеклом, содержат при температуре +25–28°C. Мини-тепличку регулярно проветривают, почву увлажняют.
НА ФОТО: Всходы пальмы появляются через 1.5–3 месяца. После образования первого листочка проводят пересадку.
Болезни и вредители:
Наиболее распространенными вредителями Кариоты жгучей являются паутинные клещи. Для борьбы с ними нужно промыть растение сильной струей воды или опрыскать инсектицидом.
Покоричневевшие кончики листьев обычно указывают на чрезмерную сухость воздуха. Однако не стоит беспокоиться, если какой-либо лист целиком желтеет, а потом становится коричневым и опадает. Это вполне естественно, примерно раз в год один из старых листьев Кариоты жгучей отмирает.
Коричневые и влажные пятна, идущие параллельно жилкам, указывают на заражение бактериями рода Pseudomonas. Поврежденные бактериальной пятнистостью листья необходимо удалить, чтобы остановить распространение болезни.
Поврежденные бактериальной пятнистостью листья необходимо удалить, чтобы остановить распространение болезни.
Кариотипов | Биология для майоров I
Результаты обучения
- Определите кариотип и опишите его использование в биологии
Выделение и микроскопическое исследование хромосом составляет основу цитогенетики и является основным методом, с помощью которого врачи выявляют хромосомные аномалии у людей. Кариотип — это количество и внешний вид хромосом, включая их длину, характер полос и положение центромеры.Чтобы получить представление о кариотипе человека, цитологи фотографируют хромосомы, а затем вырезают и вставляют каждую хромосому в диаграмму или кариограмму , также известную как идеограмма (рис. 1).
Рис. 1. Этот кариотип принадлежит женщине-человеку. Обратите внимание, что гомологичные хромосомы имеют одинаковый размер, одинаковое положение центромер и структуру полос. Мужчина-мужчина будет иметь пару хромосом XY вместо пары XX. (Источник: Андреас Блоцер и др.)
Мужчина-мужчина будет иметь пару хромосом XY вместо пары XX. (Источник: Андреас Блоцер и др.)
У данного вида хромосомы можно идентифицировать по их количеству, размеру, положению центромеры и рисунку полос.В кариотипе человека аутосом, или «хромосомы тела» (все неполовые хромосомы) обычно организованы в приблизительном порядке размера от наибольшего (хромосома 1) до наименьшего (хромосома 22). Х- и Y-хромосомы не являются аутосомами. Однако хромосома 21 на самом деле короче хромосомы 22. Это было обнаружено после того, как синдром Дауна был назван трисомией 21, что отражает то, как это заболевание возникает из-за наличия одной дополнительной хромосомы 21 (всего три). Не желая менять название этого важного заболевания, хромосома 21 сохранила свою нумерацию, несмотря на то, что описывает самый короткий набор хромосом.Хромосомные «плечи», выступающие из любого конца центромеры, могут быть обозначены как короткие или длинные, в зависимости от их относительной длины. Короткое плечо обозначается аббревиатурой p (для «маленькая»), тогда как длинное плечо обозначается сокращенно q (потому что оно следует за буквой «p» в алфавитном порядке). Каждая рука дополнительно подразделяется и обозначается номером. Используя эту систему именования, положения хромосом можно последовательно описать в научной литературе.
Короткое плечо обозначается аббревиатурой p (для «маленькая»), тогда как длинное плечо обозначается сокращенно q (потому что оно следует за буквой «p» в алфавитном порядке). Каждая рука дополнительно подразделяется и обозначается номером. Используя эту систему именования, положения хромосом можно последовательно описать в научной литературе.
Генетики используют кариограммы для определения хромосомных аберраций
Хотя Менделя называют «отцом современной генетики», он проводил свои эксперименты ни с одним из инструментов, которые генетики сегодня обычно используют.Одним из таких мощных цитологических методов является кариотипирование, метод, при котором признаки, характеризующиеся хромосомными аномалиями, могут быть идентифицированы по одной клетке. Чтобы наблюдать кариотип человека, клетки человека (например, лейкоциты) сначала собираются из образца крови или другой ткани. В лаборатории изолированные клетки стимулируются к активному делению. Затем химическое вещество под названием колхицин применяется к клеткам, чтобы остановить конденсированные хромосомы в метафазе. Затем клетки заставляют набухать с помощью гипотонического раствора, чтобы хромосомы разошлись.Наконец, образец сохраняется в фиксаторе и наносится на предметное стекло.
Затем клетки заставляют набухать с помощью гипотонического раствора, чтобы хромосомы разошлись.Наконец, образец сохраняется в фиксаторе и наносится на предметное стекло.
Затем генетик окрашивает хромосомы одним из нескольких красителей, чтобы лучше визуализировать отчетливые и воспроизводимые паттерны полос каждой пары хромосом. После окрашивания хромосомы просматривают с помощью светлопольной микроскопии. Распространенным выбором красителей является окраска по Гимзе. Окрашивание по Гимзе дает примерно 400-800 полос (плотно свернутой ДНК и конденсированных белков), расположенных вдоль всех 23 пар хромосом; опытный генетик может идентифицировать каждую полосу.В дополнение к образцу полос хромосомы дополнительно идентифицируются на основе размера и расположения центромеры. Чтобы получить классическое изображение кариотипа, в котором гомологичные пары хромосом выровнены в числовом порядке от самого длинного до самого короткого, генетик получает цифровое изображение, идентифицирует каждую хромосому и вручную размещает хромосомы в соответствии с этим шаблоном (Рисунок 1).
По сути, кариограмма может выявить генетические аномалии, при которых у человека слишком много или слишком мало хромосом на клетку.Примерами этого являются синдром Дауна, который идентифицируется третьей копией хромосомы 21, и синдром Тернера, который характеризуется наличием у женщин только одной Х-хромосомы вместо двух нормальных. Генетики также могут идентифицировать большие делеции или вставки ДНК. Например, синдром Якобсена, который включает в себя отличительные черты лица, а также пороки сердца и кровотечения, идентифицируется по делеции на хромосоме 11. Наконец, кариотип может точно определять транслокации, которые происходят, когда сегмент генетического материала отрывается от одной хромосомы и повторно прикрепляется к ней. к другой хромосоме.Транслокации связаны с некоторыми видами рака, включая хронический миелолейкоз.
При жизни Менделя наследование было абстрактным понятием, которое можно было вывести только путем скрещивания и наблюдения за чертами, выраженными потомством. Наблюдая кариограмму, современные генетики могут фактически визуализировать хромосомный состав человека, чтобы подтвердить или предсказать генетические аномалии у потомства, даже до рождения.
Наблюдая кариограмму, современные генетики могут фактически визуализировать хромосомный состав человека, чтобы подтвердить или предсказать генетические аномалии у потомства, даже до рождения.
Внесите свой вклад!
У вас была идея улучшить этот контент? Нам очень понравится ваш вклад.
Улучшить эту страницуПодробнее
Кариотип — Биологическое видео от Brightstorm
Кариотипы — это изображения, на которых изображены отдельные хромосомы. Кариоты используются учеными для изучения хромосомной регуляции и эволюционных процессов у живых существ. Ученые могут изучить количество и внешний вид хромосом. Через кариотипы часто можно увидеть генетические нарушения, такие как синдром Дауна, просто взглянув на кариотип .
В биологии есть так называемый кариотип, который часто используется для диагностики проблем с чьими-либо хромососами.
Что такое кариотип? Ну, в основном они получают клетку от кого-то и позволяют ей подвергнуться клеточному делению, и, как только она начинает делать клеточное деление, и это сжимает все свои хромосомы, они останавливают развитие клетки, а затем вытаскивают те. хромосомы, и они их фотографируют, а затем кто-то должен сесть и соединить их в пары.К счастью, в настоящее время многое из этого делается с помощью компьютера, но все же это может быть довольно сложно. Мы быстро взглянем сюда, вы можете увидеть, как это выглядит. Здесь мы видим ядро, и что они сделали, так это то, что они использовали различные цветные пятна, чтобы помочь определить различные части разных хромосом. А теперь вот как бы выглядели хромосомы. Кто-то должен был сесть там, разделить их и расставить. Желтые пятна прилипли к хромосоме номер 1, красные пятна 2 и так далее.
Хромосомы здесь расположены и названы в порядке их размера. Вы можете видеть, что эти двое подходят друг другу. Их снова называют гомологичными хромосомами. Они несут схожие черты. Это может быть от мумии, что от папы, и оба имеют версии вашей мамы и папы, скажем, гена, который может определять, можете ли вы вращать языком или форму мочки уха.
Они несут схожие черты. Это может быть от мумии, что от папы, и оба имеют версии вашей мамы и папы, скажем, гена, который может определять, можете ли вы вращать языком или форму мочки уха.
Вот x-хромосома, и вы можете видеть, что у этого человека две x-хромосомы, что говорит вам, да.Они женщины. Как бы это выглядело, если бы они были мужчинами? Что ж, у вас будет тот же образец аутосом, но здесь вы можете видеть, что хромосомы x и y выглядят значительно по-разному, причем y-хромосома намного меньше, чем x-хромосома. Он несет гораздо меньше генов.
Наконец, это дает вам представление о другом кариотипе, и все выглядит так же. Здесь внизу говорили то или это. Как правило, у вас нет выбора, нет маленьких флажков. Что примечательно, вы можете видеть этого человека, а не пары хромосом с номером 21.У этого человека есть три его копии. Это называется трисомихромосомной аномалией. Итак, это трисоми 21. Возможно, вы слышали об этом синдроме раньше. Это также известно как синдром Дауна. Это вызвано проблемами во время мейоза, когда предполагается, что хромосомы, гомологичные хромосомы разделены, но, к сожалению, что-то идет не так, и они либо остаются вместе, либо одна сторона не получает их. и это может вызвать серьезные проблемы с развитием ребенка.
Это вызвано проблемами во время мейоза, когда предполагается, что хромосомы, гомологичные хромосомы разделены, но, к сожалению, что-то идет не так, и они либо остаются вместе, либо одна сторона не получает их. и это может вызвать серьезные проблемы с развитием ребенка.
Фенотипов и кариотипов линий клеток злокачественной мезотелиомы человека
Абстрактные
Фон
Злокачественная мезотелиома — агрессивная опухоль серозных поверхностей, чаще всего плевра.Характеризованные клеточные линии представляют собой ценный инструмент для изучения биологии мезотелиомы. Целью этого исследования было разработать и биологически охарактеризовать шесть линий клеток злокачественной мезотелиомы, чтобы оценить их потенциал в качестве моделей злокачественной мезотелиомы человека.
Методы
Пять линий были инициированы при биопсии плевры и одна — при плевральном выпоте пациентов с гистологически подтвержденной злокачественной мезотелиомой. Мезотелиальное происхождение оценивали с помощью стандартной морфологии, просвечивающей электронной микроскопии (ТЕМ) и иммуноцитохимии.Характеристики роста оценивали с использованием времени удвоения популяции. Для оценки хромосомных аномалий было выполнено спектральное кариотипирование. Аутентификация донорского специфического происхождения проводилась путем снятия отпечатков пальцев ДНК с использованием панели SNP.
Мезотелиальное происхождение оценивали с помощью стандартной морфологии, просвечивающей электронной микроскопии (ТЕМ) и иммуноцитохимии.Характеристики роста оценивали с использованием времени удвоения популяции. Для оценки хромосомных аномалий было выполнено спектральное кариотипирование. Аутентификация донорского специфического происхождения проводилась путем снятия отпечатков пальцев ДНК с использованием панели SNP.
Результаты
Большинство клеточных линий демонстрируют форму веретенообразных клеток, при этом некоторые сохраняют звездчатую форму. При пассаже 2–6 все линии положительно окрашивались на кальретинин и цитокератин 19 и демонстрировали способность к независимому от закрепления росту.При пассаже с 4 по 16 время удвоения составляло от 30 до 72 часов, а при спектральном кариотипировании все линии демонстрировали числовые хромосомные аномалии от 41 до 113. Моносомия хромосом 8, 14, 22 или 17 наблюдалась в трех линиях. Одна линия показывала четыре разных кариотипа на пассаже 8, но только один кариотип на пассаже 42, а другая отображала полиплоидию на пассаже 40, которая отсутствовала на ранних пассажах. На пассажах 5-17 ПЭМ показала характерные черты ультраструктуры мезотелиомы по всем линиям, включая микроворсинки и плотные межклеточные соединения.
На пассажах 5-17 ПЭМ показала характерные черты ультраструктуры мезотелиомы по всем линиям, включая микроворсинки и плотные межклеточные соединения.
Заключение
Эти шесть клеточных линий демонстрируют различную морфологию клеток, разное время удвоения и демонстрируют различные структурные хромосомные изменения в зависимости от пассажа, наблюдаемые при злокачественных опухолях. Однако они сохраняют характерные профили иммуноцитохимической экспрессии белков мезотелиомы во время поддержания в искусственных системах культивирования. Эти характеристики подтверждают их потенциал как in vitro модельных систем для изучения клеточных, молекулярных и генетических аспектов мезотелиомы.
Образец цитирования: Relan V, Morrison L, Parsonson K, Clarke BE, Duhig EE, Windsor MN, et al. (2013) Фенотипы и кариотипы клеточных линий злокачественной мезотелиомы человека. PLoS ONE 8 (3):
e58132.
https://doi.org/10.1371/journal. pone.0058132
pone.0058132
Редактор: Раджасинг Джонсон,
Медицинский центр Канзасского университета, Соединенные Штаты Америки
Поступила: 12.10.2012; Принята к печати: 30 января 2013 г .; Опубликован: 14 марта 2013 г.
Авторские права: © 2013 Relan et al.Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Финансирование: Исследование было поддержано следующими финансирующими организациями: Фонд больницы принца Чарльза, Совет по пылевым заболеваниям (Новый Южный Уэльс, Австралия), Австралия по борьбе с раком, Стипендия практикующих врачей NHMRC (KF), Стипендия NHMRC по развитию карьеры (IY). ) и UQ Early Career Researcher (VR).Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили об отсутствии конкурирующих интересов.
Введение
Злокачественная мезотелиома — агрессивная опухоль серозных поверхностей (чаще всего плевры), обычно вызываемая воздействием асбеста. Заболеваемость варьируется во всем мире, но самая высокая в Австралии: 47 новых случаев на 100 000 населения [1] и в Великобритании: 30 на 1 000 000 в год [2].Ожидается, что из-за длительного периода ожидания до постановки диагноза заболеваемость мезотелиомой будет расти в тех частях мира, где добывали асбест или где использовались продукты из асбеста. Мезотелиома устойчива к противоопухолевому лечению, и средняя выживаемость с момента постановки диагноза составляет около 10 месяцев [3]. Лучшее понимание биологии мезотелиомы лежит в основе открытия и внедрения новых терапевтических стратегий. С этой целью моделей болезней in vitro и являются важными инструментами для изучения биологических свойств опухолей.
Преимущества моделей клеточных линий заключаются в том, что они относительно недороги по сравнению с моделями на животных, неограниченно возобновляемы, ими можно манипулировать путем трансфекции или нокдаунов для исследования функции генов, и они практичны для высокопроизводительных скрининговых исследований. Кроме того, при отсутствии стромальных и воспалительных клеток они представляют собой относительно чистый источник опухоли, который лучше подходит для оценки количества копий гена. Было показано, что культивируемые клетки, полученные из многих различных типов опухолей, сохраняют признаки рака, за исключением ангиогенеза [4], [5].
Клеточные линии мезотелиомы были полезными инструментами для демонстрации того, что продукт гена-супрессора опухоли NF2, мерлин, проявляет свой антипролиферативный эффект при мезотелиоме путем подавления экспрессии циклина D1, индуцированной активированной киназой p21 [6]. Клеточные линии мезотелиомы сыграли важную роль в понимании биологической роли остеопонтина и его изоформ. [7]. In vitro скрининговые анализы на моделях клеточных линий могут быть полезны для прогнозирования терапевтических ответов, а клеточные линии мезотелиомы оказались полезными моделями для тестирования традиционных, целевых и основанных на генах методов лечения [8].
[7]. In vitro скрининговые анализы на моделях клеточных линий могут быть полезны для прогнозирования терапевтических ответов, а клеточные линии мезотелиомы оказались полезными моделями для тестирования традиционных, целевых и основанных на генах методов лечения [8].
Хотя охарактеризованные клеточные линии мезотелиомы существуют [9] — [11], некоторые из них доступны в банках опухолей, таких как Американская коллекция типовых культур (АТСС), Европейская коллекция культур клеток животных (ECACC) и Банк клеток Австралии. В эпоху секвенирования следующего поколения хранилище молекулярно и биологически охарактеризованных и клинико-патологически аннотированных линий клеток раннего пассажа представляет собой ценный ресурс для исследований мезотелиомы. Однако, чтобы работать как in vitro как модели болезней человека, клеточные линии должны точно и стабильно отражать биологические и генетические изменения человеческого заболевания.
Это исследование было направлено на 1) создание биоинструмента аннотированных клеточных линий злокачественной мезотелиомы человека, характеризующихся морфологией, временем удвоения, иммуноцитохимическими свойствами и хромосомными изменениями, и 2) определение связанных с пассажем изменений в цитогенетических профилях линий клеток мезотелиомы человека. в долгосрочной культуре.
в долгосрочной культуре.
Методы
Получение клеточных линий злокачественной мезотелиомы человека из клинических образцов
Пациенты со злокачественной мезотелиомой, посещающие клиники больницы Принца Чарльза (TPCH), дали письменное информированное согласие на сдачу ткани для биопсии плевры и / или плевральной жидкости после получения достаточного количества диагностических образцов.Исследование было одобрено этическим комитетом больницы принца Чарльза (EC27121). Демографические, клинические и патологические данные шести доноров подробно представлены в таблице 1.
Методы создания клеточных линий были следующими:
- Образцы тканей торакоскопической биопсии с использованием видео (VAT) были разрезаны на мелкие кусочки (приблизительно 1–3 мм) и помещены в стерильные чашки Петри, содержащие 4 мл среды. Периодически добавляли свежую среду (R-10) до тех пор, пока не наблюдалось разрастание прилипших клеток.Для приготовления клеточных линий кусочки ткани удаляли, клетки собирали в свежие колбы и позволяли расти до слияния.
 Среду меняли каждые три дня, и субкультивирование проводили, когда клетки становились конфлюэнтными на 70–80%.
Среду меняли каждые три дня, и субкультивирование проводили, когда клетки становились конфлюэнтными на 70–80%. - центрифугировали (1766 об / мин в течение 7 минут), осадок промывали фосфатно-солевым буфером (PBS, Australian Chemical Reagents QLD, Австралия, кат. № 1077) и распределяли по 75-см колбам 2 (Nunc, Дания, кат. 156499).Среду (R-10) меняли каждые три дня для удаления неприлипающих клеток. Субкультивирование выполняли обработкой клеток 0,25% трипсином-ЭДТА (Invitrogen, № по каталогу 25200072) в течение двух минут при 37 ° C при слиянии.
Образцы плевральной жидкости
Все клетки культивировали в RPMI 1640 (Gibco Cat No. 21870-076) с 10% FCS (Lonza, Cat No. 14-401F) с добавлением 1% пенициллина / стрептомицина / глутамина (Gibco Cat No. 10378-016) и 0,2% фунгизон (Invitrogen Cat No. 04195780D) (R-10) и выдерживали при 37 ° C в увлажненной атмосфере при 5% CO 2 .Клетки раннего пассажа хранили в жидком азоте в замораживающей среде (90% FCS и 10% DMSO).
Тестирование на микоплазмы
Все клеточные линии оказались отрицательными на инфекцию микоплазмой с использованием стандартного набора для обнаружения микоплазм на основе ПЦР, Venor GEM (Minerva biolabs) (данные не показаны).
Морфологическая характеристика
Шесть клеточных линий были отобраны для характеристики. Клинические и демографические данные шести доноров и клиническая патология первичных опухолей мезотелиомы показаны в таблице 1.Гистологические подтипы были классифицированы как эпителиоидные в одном случае, двухфазные в трех, десмопластические в одном и неопределенные в одном случае.
Клетки выращивали на покровных стеклах до 70% слияния, промывали и фиксировали в буфере глютеральдегида при 4 ° C в течение 1 часа, а затем исследовали с помощью световой микроскопии. Просвечивающая электронная микроскопия (ПЭМ) использовалась для определения ультраструктурных характеристик. Клетки с конфлюэнтностью 70–80% промывали 1 × PBS и фиксировали 2 мл 3% буфера глютеральдегида при 4 ° C в течение 1 часа. Клетки собирали резиновым скребком и центрифугировали при 1200 об / мин в течение 5 мин.Супернатант удаляли и добавляли свежий глютеральдегидный буфер. Осадки клеток вторично фиксировали тетроксидом осмия и окрашивали en bloc уранилацетатом и заливали в эпоксидную смолу Procure 812. Ультратонкие срезы вырезали при длине волны 70–90 нм, окрашивали цитратом свинца и исследовали с помощью просвечивающего электронного микроскопа (JEOL JEM-1011, 100 кВ, JEOL Australasia Pty Ltd).
Отпечаток ДНК
Чтобы проверить происхождение, профили клеточных линий для 45 SNP, сгенерированные Sequenom с использованием панели iPLEX Sample ID Plus, сравнивали с профилями SNP периферической конституциональной ДНК от каждого донора.
Характеристики роста
5000 клеток каждой линии на пассаже № 8–16 высевали в трехкратные лунки 24-луночного планшета (2500 клеток / см 2 ) и выращивали в среде (R-10). Клетки подсчитывали через 24 часа, 48 часов, 72 часа, 96 часов, 7 дней, 9 дней и 11 дней. Жизнеспособность клеток оценивали по исключению трипанового синего. Время удвоения рассчитывалось по алгоритму, предоставленному http://www.doubling-time.com. [12].
Цитогенетический анализ
Хромосомные препараты клеток получали следующим образом: Колцемид (раствор демеколцина D1925 Sigma 10 мкг / мл в HBSS) (0.Конечная концентрация 04 мкг / мл) добавляли к полуконфлюэнтным культурам (70%) за 16-17 часов до сбора урожая. Метафазные клетки собирали трипсинизацией, обрабатывали гипотоническим раствором (0,56% KCl) в течение 15 мин при 37 ° C и дважды фиксировали в уксусной кислоте (одна часть) / метаноле (три части). Клетки помещали на чистые предметные стекла и отправляли в Applied Spectral Imaging (Израиль) для спектрального кариотипирования (SKY). Зонд SKY, содержащий все 24 библиотеки меченых хромосом, гибридизовали одновременно с метафазами.После отмывки предметных стекла были окрашены 4’6-диамидино-2-фенилиндолом (DAPI) в антифадной среде. Выбранные метафазы были захвачены и проанализированы с использованием системы биоимиджинга SD 300 (ASI Ltd), с использованием программного обеспечения производителя для сбора и анализа цветных хромосом (HiSKY). Изображения DAPI регистрировались отдельно, а затем хромосомы автоматически сортировались в таблице кариотипов и анализировались на предмет структурных и / или числовых аберраций. Из каждой выборки случайным образом были выбраны 7–10 метафаз для полного анализа из разных областей слайдов.
Иммуноцитохимические исследования
Окрашивание, указывающее на мезотелиальное происхождение, проводили с использованием следующих антител: антикалретинин (Zymed Invitrogen, Carlsbad CA Cat No. 180211) в разведении 1-50 и антицитокератин-19 (Dako, Clone RCK108) в разведении 1∶100 для окрашивания клеток. Клетки выращивали на покровных стеклах до 80% конфлюэнтности. Окрашивание иммуноцитохимическими маркерами проводили с использованием набора стрептавидин-биотин пероксидазы хрена (SAB / HRP) (Dako, North America, Carpentaria, CA, кат. № K3468) с временем инкубации 1 час при комнатной температуре для каждого первичного антитела.Интенсивность иммуноцитохимических реакций оценивали полуколичественным методом с использованием следующей шкалы: отрицательный: нет положительных клеток, слабый: <10%, средний: 10–60%, высокий:> 60%. Клеточная линия JU77, ранее хорошо охарактеризованная линия клеток злокачественной мезотелиомы [9], была использована в качестве положительного контроля, а клетки, окрашенные без первичных антител, были взяты в качестве отрицательного контроля.
Рост, не зависящий от якоря
Независимый от закрепления рост сильно коррелирует с опухолью [13].Для оценки этого свойства были выполнены анализы образования колоний на мягком агаре. Вкратце, готовили 0,5% агар (базовый слой) и 0,37% агар (верхний слой) (агар Sea Kem, FMC, Филадельфия, Пенсильвания). Базовый слой выливали в 96-луночный планшет для культивирования клеток и оставляли для застывания в течение 5 минут. Верхний слой был смешан с 10000 ячеек и вылился поверх основного слоя. Клеткам давали возможность расти в течение 10 дней, пока не стали видны колонии. WST-1 добавляли в каждую лунку, инкубировали при 37 ° C, и планшеты считывали при оптической плотности при 450 нм [14].Клеточную линию A549 (линия клеток аденокарциномы легкого человека) использовали в качестве положительного контроля, а фибробласты крайней плоти новорожденных — в качестве отрицательного контроля в этом анализе.
Результаты
Жизнеспособные клетки всех линий, о которых здесь сообщается, можно было извлечь из криоконсервации, впоследствии они росли до слияния и размножались путем пассирования. ДНК-фингерпринтинг был проведен на четырех клеточных линиях, показывающих совпадающие профили SNP между ДНК крови и клеточной линии (MM04, MM05, MM13, MM1081) (данные не показаны), подтверждая происхождение каждой линии от донора, таким образом подтверждая аннотацию этих линий относительно клинико-патологическая характеристика пациентов-доноров и их опухолей.
Морфологические, ультраструктурные и иммуногистохимические свойства культивируемых клеток мезотелиомы человека
Все клеточные линии (MM04, MM05, MM12, MM13, MM1081 и PF1038) образовывали монослои с различными морфологическими типами клеток (рисунок 1, таблица 2). PF1038 демонстрировал две разные морфологии на ранних пассажах (p6) (веретенообразные и округлые клетки), но веретеновидные клетки доминировали на более поздних пассажах (p16) (Рисунок 1). Просвечивающая электронная микроскопия во всех шести линиях показала характерные черты ультраструктуры мезотелиомы: тонкие короткие микроворсинки без подлежащей терминальной филаментозной сети, цитоплазма, содержащая органеллы и промежуточные филаменты, и плотные межклеточные соединения (Рисунок 2) [15].Клетки из всех шести линий [MM04 (p4), MM05 (p5), MM12 (p5), MM13 (p2), MM1081 (p5) и PF1038 (p3)] положительно окрашены на кальретинин и цитокератин 19 с помощью иммуноцитохимии (таблица 2).
Рис. 2. Просвечивающая электронная микрофотография клеточных линий.
Клеточные линии, показывающие микроворсинки (темные стрелки) и плотные внутриклеточные соединения (пунктирные стрелки). MM05 (A), MM04 (B), MM12 (C), MM13 (D), MM1081 (E) и PF1038 (F).
https://doi.org/10.1371/journal.pone.0058132.g002
Характеристики роста
Характеристики роста изучались на следующих пассажах (p) — MM04 (p11) MM05 (p16), MM12 (p5), MM13 (p9), MM1081 (p6) и PF1038 (p6). Время удвоения варьировалось от 30 до 72 часов (таблица 2). Не было обнаружено никакой связи между временем удвоения и гистологической классификацией подтипов. Все линии образовывали колонии в мягком агаре, что соответствовало способности роста, не зависящей от закрепления (рис. 3).
Рис. 3. Анализ роста, не зависящего от анкеровки.
Анализ, показывающий образование колоний для всех клеточных линий (A549, NFF, MM04, MM05, MM12, MM13, MM1081 и PF1038). 10000 клеток выращивали на 96-луночных планшетах на мягком агаре в течение 10 дней перед добавлением Wst-1. Оптическую плотность (OD) измеряли при 450 нм и относили к 620 нм. Клеточную линию A549 (линия эпителиальных клеток аденокарциномы легкого человека) использовали в качестве положительного контроля, а в качестве отрицательного контроля использовали NFF (фибробласты крайней плоти новорожденных).
https://doi.org/10.1371/journal.pone.0058132.g003
Кариотипы
Хромосомные аномалии перечислены в таблице 3. MM12 p10 (двухфазный) и MM1081 p4 (эпителиоид) оба показали полиплоидию. Единственная копия хромосом 8, 14 и 22 наблюдалась в двух клеточных линиях (MM04 p8 и PF1038 p12) и хромосомы 17 в MM04, MM05p5 и PF1038. Делеции и транслокации обычно наблюдались в хромосомах 1, 5 и 6 в эпителиоидной клеточной линии (MM1081) и в хромосомах 1, 9 и 19 в двухфазных клеточных линиях (MM05 и MM12).В MM04 четыре различных кариотипа наблюдались на пятом пассаже. Одна клеточная линия (MM13) не могла быть кариотипирована из-за конденсированного распространения метафаз.
Изменения кариотипа, связанные с пассажем
Две клеточные линии (MM04 и MM05), изученные как на ранних (p8 и p5 соответственно), так и на поздних (p40 и p42 соответственно) пассажах, показали хромосомные аномалии. У MM05 развилась полиплоидия при позднем пассаже, но при этом продолжались аномалии, аналогичные наблюдаемым при ранних пассажах. Поздние пассажи показали аналогичные транслокации в хромосомах 1, 8, 11 и 17, что и на ранних пассажах (таблица 4).Ранние пассажи MM04 показали четыре различных кариотипа, тогда как только один наблюдался при позднем пассаже (Таблица 4).
Обсуждение
Создание первичных клеточных линий в качестве модели заболевания потенциально имеет большое значение при изучении мезотелиомы на клеточном, молекулярном и генетическом уровнях. Мезотелиома легко размножается в клеточной культуре из биоптатов опухолей человека и плевральных выпотов. В течение четырех лет (2008–2011 гг.) Мы установили двадцать одну клеточную линию (определяемую как успешная субкультура из первичной культуры [16]) из двадцати пяти образцов (пятнадцать резецированных биопсий опухоли человека и десять плевральных выпотов), представляющих общий уровень успеха 84%.Как модели человеческого заболевания, эти клеточные линии можно изучать и использовать для ответа на конкретные исследовательские вопросы, и потенциально они могут предложить исследователям с конкретными целями доступ к системам, которые тесно связаны с человеческим заболеванием. Чтобы оценить этот потенциал, мы описываем здесь биологические характеристики шести из этих недавно созданных клеточных линий.
Морфология и характеристики роста
Морфологические характеристики и характеристики роста шести клеточных линий, представленных здесь, соответствовали тем, которые ранее были задокументированы для клеточных линий мезотелиомы [9] — [11].Одна клеточная линия (PF1038) претерпела морфологические изменения при пассировании, возможно, в результате избирательной адаптации к искусственным условиям культивирования [17]. Микроворсинки характерны для мезотелиальных клеток. ПЭМ ультраструктура культивируемых клеток мезотелиомы показала микроворсинки различной длины в разных клеточных линиях, но в целом микроворсинки в культивируемых клетках мезотелиомы были короче, чем те, которые наблюдались в гистологических образцах мезотелиомы. Пасс и др. Также сообщили о переменной длине микроворсинок в клеточных линиях мезотелиомы [18].Время удвоения клеток является важным параметром как для скрининга лекарств, так и для функциональных исследований, поскольку на результат этих типов экспериментов может влиять фаза клеточного цикла. Время удвоения для ранних пассажей этих линий варьировалось от 30 до 72 часов в пределах диапазона времени удвоения, о котором сообщалось ранее [9], [18], [19]. Все эти линии мезотелиомы демонстрировали независимый от закрепления рост (способность образовывать колонии в полутвердых средах), что является признаком злокачественности [20], наиболее точным и строгим методом in vitro анализа на опухолевый потенциал и сильно коррелировало с онкогенностью у животных [13] , [21].Мы обнаружили, что эти клеточные линии подходят как в качестве культур, прикрепленных к пластику, так и в мягком агаре для тестирования активности существующих химиотерапевтических агентов (результаты будут опубликованы отдельно).
Иммуноцитохимия
В настоящее время не существует индивидуального иммуногистохимического маркера, который обеспечивает 100% специфичность и высокую чувствительность для диагностики мезотелиомы, а также маркера со 100% отрицательной прогностической ценностью. Наиболее полезными мезотелиальными и эпителиальными маркерами, предложенными для диагностики мезотелиомы, являются кальретинин (витамин D-зависимый кальций-связывающий белок, участвующий в передаче сигналов кальция), HBME-1, тромбомодулин, WT-1, мезотелин и подопланин в качестве мезотелиальных маркеров и pCEA. , Бер-Ер4, TTF-2, B72.3 в качестве эпителиальных маркеров [22]. Высокомолекулярные цитокератины (18 и 19) экспрессируются в мезотелиальных клетках [23], а растворимый цитокератин-19 ранее был обнаружен в высоких концентрациях в двух семейных случаях мезотелиомы [24]. Соотношение цитокератин-19 / СЕА является полезным диагностическим маркером злокачественной мезотелиомы [25]. Хотя расширенная панель маркеров ИГХ могла бы позволить более полную характеристику, все шесть клеточных линий экспрессировали цитокератин-19 и кальретинин.
Цитогенетические изменения
Клеточные линии мезотелиомы демонстрируют сложные структурные и численные хромосомные аномалии при спектральном кариотипическом анализе — молекулярно-цитогенетическом методе, с помощью которого могут быть обнаружены даже сложные хромосомные аномалии, которые не могут быть обнаружены с помощью обычного G-бэндинга или методов FISH.О моносомии 17, обнаруженной в трех из пяти клеточных линий, сообщалось ранее при мезотелиоме [26], и она может быть вовлечена в функциональную инактивацию гена p53 из-за связывания белка Tag SV40 [27]. Перестройки с участием хромосомы 1 были обнаружены во всех линиях клеток мезотелиомы. Точки разрыва и делеции в регионах хромосомы 1, расположенных рядом с протоонкогенами Blym, L-Myc и sci, были описаны в различных солидных опухолях [28], включая мезотелиому [29]. Множественные области потери аллелей от 6q были зарегистрированы при мезотелиоме [30], [31], и мы наблюдали перестройки хромосомы 6 в одной (из пяти) линий.Аллельные потери в трех известных областях-супрессорах опухоли (22q, который включает маркер Nf2 (NF2CA3), 9p для гена p16 и 3p для гена FHIT) и в других областях 14q и 6q также часто встречаются при мезотелиоме [32] — [34]. ]. На CGH Линдхольм и его коллеги обнаружили потери в областях 1p, 3p, 6q, 9p, 13, 14 и 22 и рост в 17q [35]. Как частичная потеря, так и полная моносомия 22-й хромосомы наблюдались при мезотелиоме ранее [31], [36], [37], и мы наблюдали моносомию 22 в двух из пяти линий, описанных здесь.[35].
Изменения, связанные с прохождением
Известно, что геномная нестабильность возникает при длительном культивировании линий опухолевых клеток [33]. Полиплоидия, которую мы наблюдали в одной клеточной линии (MM05), сообщается как частое явление при длительном культивировании [38]. Дзанацци и его коллеги также сообщили об изменениях, связанных с пассажем, в клеточной линии мезотелиомы, отметив исчезновение определенных изменений числа копий в более поздних пассажах и появление новых аберраций [39]. Мы также нашли доказательства отбора с редукцией до одного кариотипа в более поздних пассажах MM04, что предполагает отбор субпопуляции клеток с этим кариотипом; что, возможно, давало какое-то преимущество в росте.
На линии мезотелиомы, доступные из различных банков клеток, могут влиять связанные с культурой цитогенетические и другие изменения, влияющие на их пригодность для различных исследовательских целей. Аннотации репозиториев клеточных линий с указанием подтвержденного происхождения, количества пассажей и всесторонней характеристики необходимы для обоснования их применимости в качестве in vitro модельных систем заболеваний человека. Характеристика этих шести клеточных линий увеличивает биоресурсы, доступные для будущих исследований мезотелиомы.
Вклад авторов
Помощь в оформлении исследования и подготовке рукописи: KF IY. Задуманы и разработаны эксперименты: В.Р. РБ. Проведены эксперименты: В.Р. Л.М. КП. Проанализированы данные: ВР РБ. Внесенные реактивы / материалы / инструменты анализа: BC ED MW KM RN LP EM DC. Написал статью: В.Р. РБ.
Ссылки
- 1.
Безопасная работа Австралия (2009 г.) Мезотелиома в Австралии — ЗАБОЛЕВАЕМОСТЬ 1982– 2005 гг., СМЕРТИ 1997–2006 гг .; Мезотелиома в Австралии. - 2.
Bianchi CBT (2007) Злокачественная мезотелиома: глобальная заболеваемость и связь с асбестом. Промышленное здравоохранение 45 379–387. - 3.
Bowman RRV, Hughes B (2011) Медицинское лечение мезотелиомы. Австралийский проповедник 34 5: 144–147. - 4.
Sato G (2008) Культура тканей: нереализованный потенциал. Цитотехнология 57. - 5.
Сато GH, Сато JD, Okamoto T, McKeehan WL, Barnes DW (2010) Культура тканей: неограниченный потенциал.In vitro Cell Dev Biol Anim 46: 590–594. - 6.
Сяо Г. Х. Г., Шетлер Дж., Скеле К., Алтомаре Д. А., Пестелл Р. Г. и др. (2005) Продукт гена-супрессора опухоли NF2, мерлин, ингибирует пролиферацию клеток и развитие клеточного цикла, подавляя экспрессию циклина D1. Mol Cell Biol 25: 2384–2394. - 7.
Иванов С.В., Гопараджу С.М., Чен Ю., Бек А., Пасс Х.И. (2009) Онкогенные свойства альтернативных изоформ остеопонтина при мезотелиоме. Biochem Biophys Res Commun 382: 514–518. - 8.
Veldwijk MR, Jauch A, Laufs S, Zeller WJ, Wenz F, et al. (2008) Характеристика клеточных линий мезотелиомы человека как опухолевых моделей для суицидальной генной терапии. Онкология 31: 91–96. - 9.
Мэннинг Л.С., Уитакер Д., Марч А.Р., Гарлепп М.Дж., Дэвис М.Р. и др. (1991) Создание и характеристика пяти линий клеток злокачественной мезотелиомы человека, полученных из плевральных выпотов. Int J Cancer 47: 285–290. - 10.
Усами Н., Фукуи Т., Кондо М., Танигучи Т., Йокояма Т. и др.(2006) Установление и характеристика четырех клеточных линий злокачественной мезотелиомы плевры от японских пациентов. Cancer Sci 97: 387–394. - 11.
Philippeaux MM, Dahoun S, Barnet M, Robert JH, Mauël J, et al. (2004) Создание постоянных клеточных линий, очищенных от мезотелиомы человека: морфологические аспекты, экспрессия новых маркеров и кариотипический анализ. Histochem Cell Biol 122: 249–260. - 12.
Рот V (2006) http://www.doubling-time.com/compute.php.По состоянию на 2012 г., февраль - 13.
Ори С., Чанг Дж. Т., Андречек Э. Р., Мацумура Н., Баба Т. и др. (2009) Сигнатура роста клеток, не зависящая от закрепления, позволяет идентифицировать опухоли с метастатическим онкогеном. 28: 2796–2805. - 14.
Дон У Кан S-HL, Чон Ван Юн и др. (2010) Фосфолипаза D1 управляет петлей положительной обратной связи для усиления сигнальной оси Wnt / b-Catenin / TCF. Cancer Res 70: 4233–4242. - 15.
Suster S, Moran C (2005) Злокачественная мезотелиома: текущий статус гистопатологической диагностики и молекулярного профиля.Эксперт Рев Мол Диаг 5: 715–723. - 16.
Шаффер В.И. (1990) Терминология, связанная с культурой клеток, тканей и органов, молекулярной биологией и молекулярной генетикой. Комитет по терминологии Ассоциации тканевых культур. In vitro Cell Dev Biol 26: 97–101. - 17.
Gazdar AF, Carney DN, Guccion JG, Baylin SB (1981) Мелкоклеточная карцинома легкого: клеточное происхождение и связь с другими легочными опухолями. В Греко, Ф. А., Олдхэм, Р. К. и Банн, П. А. (ред.), Мелкоклеточная карцинома легкого, Grune & Stratton, Нью-Йорк,: 145–175. - 18.
Pass HI SE, Oie H, Tsokos MG, Abati AD, Fetsch PA, et al .. (1995) Характеристики девяти вновь полученных линий клеток мезотелиомы .. Ann Thorac Surg 59. - 19.
Pelin-Enlund K, Husgafvel-Pursiainen K, Tammilehto L, Klockars M, Jantunen K, et al. (1990) Связанная с асбестом злокачественная мезотелиома: рост, цитология, онкогенность и согласованные хромосомные данные в клеточных линиях пяти пациентов. Канцерогенез 11: 673–681. - 20.
Ханахан Д., Вайнберг Р.А. (2000) Признаки рака.Ячейка 100: 57–70. - 21.
Фридман В.Х., Шин С.И. (1974) Клеточная туморогенность у мышей nude: корреляция с ростом клеток в полутвердой среде. Ячейка 3: 355–359. - 22.
Марчевский А.М. (2008) Применение иммуногистохимии для диагностики злокачественной мезотелиомы. Arch Pathol Lab Med 132: 397–401. - 23.
Herrick SE, Mutsaers SE (2004) Мезотелиальные клетки-предшественники и их потенциал в тканевой инженерии. Международный журнал биохимии и клеточной биологии 36: 621–642. - 24.
Хияма Дж., Марукава М., Шиота Ю., Оно Т., Имаи С. и др. (1998) Два случая семейной мезотелиомы с высокими концентрациями растворимого фрагмента цитокератина 19 в плевральной жидкости. Intern Med 37. - 25.
Судзуки Х., Хирасима Т., Кобаяши М., Сасада С., Окамото Н. и др. (2010) Соотношение фрагмент цитокератина 19 / карциноэмбриональный антиген в плевральном выпоте является полезным маркером для выявления злокачественной мезотелиомы плевры. Anticancer Res 30: 4343–4346. - 26.Оренго AM, Spoletini L, Procopio A, Favoni RE, De Cupis A и др. (1999) Создание четырех новых клеточных линий мезотелиомы: характеристика ультраструктурным и иммунофенотипическим анализом. Eur Respir J 13: 527–534.
- 27.
Carbone M, Rizzo P, Grimley PM, Procopio A, Mew DJ и др. (1997) Антиген большого Т обезьяньего вируса 40 связывает р53 в мезотелиомах человека. Nat Med 3: 908–912. - 28.
Сандберг А.А. (1983) Хромосомная гипотеза онкогенеза.Cancer Genet Cytogenet 8: 277–285. - 29.
Tiainen M, Tammilehto L, Mattson K, Knuutila S (1988) Неслучайные хромосомные аномалии при злокачественной мезотелиоме плевры. Cancer Genet Cytogenet 33: 251. - 30.
Björkqvist AM, Tammilehto L, Anttila S, Mattson K, Knuutila S (1997) Повторяющиеся изменения числа копий ДНК в 1q, 4q, 6q, 9p, 13q, 14q и 22q, обнаруженные сравнительной геномной гибридизацией при злокачественной мезотелиоме. Br J Cancer 75: 523–527. - 31.Neragi-Miandoab S, Sugarbaker DJ (2009) Хромосомная делеция у пациентов со злокачественной мезотелиомой плевры. Взаимодействие CardioVasc Thorac Surg 9: 42–44.
- 32.
Пилкканен Л. С., Олликайнен Т., Маттсон К., Нордлинг С., Карпен О. и др. (2002) Одновременный LOH в нескольких локусах злокачественной мезотелиомы человека с преимущественной потерей области гена NF2. Oncol Rep 9: 955–959. - 33.
UKCCCR (2000) Руководство по использованию клеточных линий в исследованиях рака.Британский журнал рака 82: 1495–1509. - 34.
Krismann M, Müller KM, Jaworska M, Johnen G (2004) Патологическая анатомия и молекулярная патология. Рак легкого 45: 29–33. - 35.
Линдхольм П.М., Салменкиви К., Ваухконен Х., Николсон А.Г., Анттила С. и др. (2007) Анализ числа копий гена при злокачественной плевральной мезотелиоме с использованием массива олигонуклеотидов CGH. Cytogenet Genome Res 119: 46–52. - 36.
Тиайнен М., Таммилехто Л., Раутонен Дж., Туоми Т., Маттсон К. и др.(1989) Хромосомные аномалии и их корреляция с воздействием асбеста и выживаемостью у пациентов с мезотелиомой. Br J Cancer 60: 618–626. - 37.
Knudson A (1995) Асбест и мезотелиома: генетические уроки трагедии. Proc Natl Acad Sci 92: 10819–10820. - 38.
Wenger SL, Sargent LM, Bamezai R, Bairwa N, Grant SG (2004) Сравнение установленных клеточных линий на разных пассажах по кариотипу и сравнительной геномной гибридизации. Biosci Rep 24: 631–639. - 39.
Дзанацци Ч., Херсмус Р., Велтман И.М., Гиллис А.Дж., ван Друнен Э. и др. (2007) Профили экспрессии генов и изменения числа копий генов в клеточных линиях злокачественной мезотелиомы. Гены Хромосомы Рак 46: 895–908.
Сортировка раковых кариотипов с помощью двойных разрезов и соединений, дупликаций и делеций | Биоинформатика
Аннотация
Мотивация
Проблемы перестройки генома занимают центральное место как в эволюции, так и в исследованиях рака.Большинство моделей реаранжировки генома предполагают, что геном содержит одну копию каждого гена, и единственные изменения в геноме являются структурными, то есть переупорядочением сегментов. Напротив, геномы опухолей также претерпевают количественные изменения, такие как делеции и дупликации, и, таким образом, количество копий генов варьируется. Работа с неравным содержанием генов — очень сложная задача, которую на сегодняшний день решают немногие алгоритмы. Чтобы проследить эволюцию генома во время туморогенеза, необходимы более реалистичные модели.
Результаты
Здесь мы представляем модель эволюции геномов с множественными копиями генов с использованием типов операций: двойное разрезание и соединение, дупликации и делеции.Модель поддерживает следующие события: инверсии , , транслокации , , тандемные дупликации , , сегментарные делеции , хромосомные амплификации, и , делеции и , охватывающие большинство типов структурных и числовых изменений, наблюдаемых в образцах опухолей. Наша цель — найти серию операций минимальной длины, которые преобразуют один кариотип в другой. Мы показываем, что проблема NP-сложна, и даем формулировку целочисленного линейного программирования, которая решает проблему точно при некоторых мягких предположениях.Мы тестируем наш метод на смоделированных геномах и геномах рака яичников. Наше исследование продвигает современное состояние по двум направлениям: оно позволяет использовать более широкий набор операций, чем существующие модели, что делает его более реалистичным, и это первое исследование, в котором предпринимается попытка воссоздать полную последовательность структурных и числовых событий во время развития рака.
1 Введение
Во время рака в геноме опухоли быстро накапливаются соматические мутации. В то время как некоторые мутации небольшие и затрагивают одну или несколько баз, другие представляют собой крупномасштабные события.Здесь мы сосредоточимся на последнем. Они включают инверсии, хромосомные транслокации, тандемные дупликации, сегментарные делеции и амплификации или потери целой хромосомы (Vogelstein et al. , 2013). Некоторые типы рака преимущественно характеризуются этими типами мутаций (Ciriello et al. , 2013). Понимание этих изменений может помочь в прогнозировании прогрессирования заболевания и результатов медицинского вмешательства (Fielding, 2010). Например, было показано, что ранние транслокации и тандемные дупликации при раке яичников способствуют лекарственной чувствительности и клональной экспансии (Ng et al., 2012).
1.1 Типы аберраций и данные генома рака
Номер копии ( CN ) геномного сегмента — это количество копий сегмента, содержащегося в геноме. В здоровом диплоидном геноме каждый сегмент имеет CN = 2. В сегментарной делеции сегмент ДНК удален, что приводит к геному с одной копией сегмента. При делеции хромосомы удаляется вся хромосома. В тандемной дупликации сегмент хромосомы дублируется и вставляется сразу после исходного.Дупликация хромосомы (или амплификация ) создает дополнительную копию всей хромосомы. В целом делеции и дупликации могут изменять как структуру, так и CN генома.
Другие аберрации изменяют только структуру генома, но не его ХН. В инверсии (или инверсии ) сегмент хромосомы перевернут относительно своей исходной ориентации. В транслокации две хромосомы обмениваются концевыми сегментами.
Учитывая геном зародышевой линии G и геном опухоли T , точка разрыва — это позиция между двумя основаниями, которые идут подряд в G , но не в T . Инверсии и транслокации вводят две точки останова, сегментные делеции и тандемные дупликации вводят одну точку останова, а хромосомные дупликации / делеции не создают точек останова.
Основным источником данных для анализа генома рака сегодня является глубокое секвенирование.Это позволяет делать выводы об изменениях CN на основе глубины чтения (Ding et al. , 2014) и облегчает вывод точек останова в геноме, обнаружение структурных вариантов и идентификацию перестроек (Korbel et al. , 2007). Если сопоставленные местоположения двух концов чтения с парным концом не соответствуют длине чтения, чтение называется несогласованным и предлагает точку останова в геноме. Расположение и ориентация таких несогласованных считываний могут помочь определить тип события (Abo et al., 2015). Точное воссоздание числовых и структурных вариаций на основе данных глубокого секвенирования остается проблемой, и для этой задачи было разработано множество вычислительных методов (Ding et al. , 2014).
1.2 Модели реаранжировки генома
За последние два десятилетия было изучено множество моделей реаранжировки генома. Классическая модель ищет кратчайшую последовательность инверсий и транслокаций, которые превращают один геном в другой (Hannenhalli and Pevzner, 1996, 1999).Такая последовательность называется сценарием сортировки . Позже была предложена более простая модель на основе с двойным разрезом и соединением ( DCJ ). В DCJ геном разрезан в двух местах, и четыре свободных конца повторно соединены в две пары. Эта модель может представлять как инверсии, так и транслокации (Bergeron et al. , 2006; Yancopoulos et al. , 2005). Фейджао и Мейданис (2011) представили более простую модель под названием single-cut-or-join ( SCoJ ), в которой каждая операция либо разрезает геном, либо соединяет два свободных конца.Эти модели DCJ и SCoJ предполагают наличие единственной копии каждого геномного сегмента и отсутствие операции, изменяющей CN. Существующие модели с множественными копиями сегментов часто приводят к NP-трудным проблемам (Shao and Lin, 2012; Tannier et al. , 2009). Некоторые модели реорганизации предполагают, что точка останова не может использоваться дважды в сценарии сортировки (Pevzner and Tesler, 2003).
Некоторые модели обрабатывают несколько копий наряду с другими типами операций. Некоторые допускают вставки или делеции геномных сегментов вместе с DCJ, но только для недуплицированных сегментов (da Silva et al., 2012). Для сортировки множественных копий геномов с использованием только DCJ были даны как точная целочисленная линейная программа (ILP), так и аппроксимация (Shao et al. , 2015; Shao and Lin, 2012). Бадер (2010) предоставил эвристику для сортировки по DCJ, дублированию и удалению. Шао и Морет (2015) разработали ILP для сортировки геномов с множественными копиями через DCJ и определенным типом сегментарных дупликаций. Зейра и Шамир (2017) предложили линейный алгоритм сортировки по SCoJ и хромосомным дупликациям в геномах с максимум двумя копиями.Озери-Флато и Шамир (2009) изучили модель с определенными дупликациями, делециями и SCoJ и предложили алгоритм трех приближений, который хорошо работает с геномами рака.
В нескольких моделях была предпринята попытка ввести операции модификации CN. Chowdhury et al. (2014) определил расстояние редактирования между профилями CN, полученными из FISH, где операциями редактирования являются амплификация или удаление отдельных генов, отдельных хромосом или всего генома. Однако эти методы адаптированы к данным FISH с ограниченным количеством генов.Schwarz et al. (2014) представил модель, которая позволяет амплификации и удаления смежных сегментов. Позже был дан алгоритм линейного времени для этого расстояния редактирования (Zeira et al. , 2017). Однако все эти модели учитывают только модификации CN, но не структурные перестройки.
1.3 Графические модели опухолевых перестроек
Теория графов внесла значительный вклад в область геномных перестроек. Графики точек останова широко используются для представления и анализа перестроенных геномов в процессе эволюции (Bafna and Pvezner, 1996; Hannenhalli and Pevzner, 1995b) и в геномах рака (Raphael et al., 2003). Гринман и др. (2012) создали модели, которые расширили график контрольных точек, и использовали их, чтобы вывести некоторый порядок мутаций опухолей.
Oesper et al. (2012) дополнительно расширил граф точек останова структурой, называемой графом интервальной смежности , который представляет точки останова, несогласованные чтения и информацию CN. Их метод, названный PREGO , использует количество считываний, поддерживающих каждое ребро, для разрешения CN геномных сегментов и выявления несогласованных смежностей в геноме опухоли.Разложение этого графа на набор путей соответствует набору хромосом. Было показано, что PREGO эффективно идентифицирует комплексную перестройку в данных секвенирования рака яичников. Эйтан и Шамир (2017) расширили эту модель и протестировали ее на обширных симуляторах и на реальных данных о раке.
1,4 Наш вклад
Мы предлагаем здесь модель структурных и числовых изменений, которым подвергается геном с множественными сегментными копиями. Разрешенными операциями являются DCJ, тандемные дупликации, сегментарные делеции и дупликации и делеции целых хромосом.Эта модель охватывает многие общие аберрации при раке и не исключает повторного использования точки останова. Однако мы ограничиваем как дублирование, так и удаление простыми путями, которые включают не более одной копии каждого сегмента. Аналогично Oesper et al. (2012) геномы представлены CN каждого сегмента и смежностями между ними. Наша цель — найти кратчайшую серию операций, которые преобразуют один геном в другой, например нормальный геном к наблюдаемому геному опухоли. В отличие от большинства моделей, здесь мы сосредоточены на поиске реальной последовательности событий.Мы показываем, что проблема является NP-сложной, даем формулировку ILP для решения этой проблемы и применяем ее к моделированным данным и данным опухоли яичников. Алгоритм способен разрешить последовательность событий для опухолей средней сложности.
Исследование продвигает современный уровень анализа реаранжировки генома при раке двумя способами: оно позволяет использовать более широкий набор операций, чем существующие модели, что делает его более реалистичным, а также является первой моделью, пытающейся реконструировать полную последовательность. структурных и числовых событий во время эволюции рака.
2 Материалы и методы
В этом разделе мы представляем нашу модель и формулируем ПДОДИ для ее решения.
2.1 Обозначение
Геном содержит набор сущностей G = G * ∪TG. G * представляет собой набор из n генов , обозначенных 1,…, n. Каждый ген g∈G имеет две конечностей , голову g h и хвост g t . W.l.o.g., обозначим gt = 2g и gh = 2g + 1 для каждого g∈G. TG — это набор особых генов, называемых теломерами .У каждой теломеры есть только одна оконечность. Теломеры делятся на пары, которые различаются как левый теломер и правый теломер . У левого теломера есть только голова, а у правого теломера только хвост. Левая и правая теломеры соответствуют началу и концу хромосом в реальном геноме. Гены в G * также называются внутренними генами .
Обозначим через T множество конечностей, соответствующих теломерам, а через E * = {gt, gh | g∈G *} — множество конечностей внутренних генов.Множество всех оконечностей обозначим E = E * ∪T. Повсюду для конечности e мы будем обозначать g ( e ) ген, которому она принадлежит.
Кариотип представлен парой K = (cn, adj) . cn: G → ℕ — это профиль CN гена , а adj: E × E → ℕ — это CN-матрица смежности , такая что ∀e∈E, cn (g (e)) = ∑e′∈Eadj (e , e ′) . Обратите внимание, что adj является симметричным, и разные копии гена или смежности неотличимы.
Граф кариотипа из K представляет собой взвешенный неориентированный граф G = (E, E, W), подобный графу интервальной смежности (Oesper et al., 2012 г .; Рисунок 1). Набор ребер E = EI∪EA состоит из ребер интервала E I и смежных ребер E A . Ребра интервала Ei = {(gt, gh) | g∈G *, cn (g)> 0} соответствуют генам и ребрам смежности Ei = {(u, v) | u, v∈E, adj (u, v) > 0} соответствуют смежности в кариотипе. Вес W: E → ℕ определяется как CN ребра, т. Е.
W (u, v) = {cn (g), если (u, v) = (gt, gh) ∈EIadj (u, v), если (u, v) ∈EA
Удаление копии существующего ребра ( u , v ) из G приводит к новому графику, в котором CN ( u , v ) равен меньше на 1, и ребро удаляется из графа, если его новый CN равен нулю.Аналогично, добавление копии ребра ( u , v ) к G приводит к новому графу G ‘= (E, E’, W ‘), в котором CN ребра ( u , v ) увеличивается на 1, если он существует в G , или добавляется новое ребро ( u , v ) с CN = 1.
Рис. 1.
Влияние модельных операций на граф кариотипа. Сплошные кромки: кромки интервала; пунктирные края: примыкания; номера по краям: CN; знаки молнии: точки останова.Нарисованные линии показывают путь, затронутый операцией. Последовательности генов, соответствующие возможным хромосомам, показаны под каждым графиком, причем каждая хромосома выделена отдельной строкой. Гены a, b, c, d соответствуют сегментам на крайнем левом графике кариотипа сверху вниз.
Рис. 1.
Влияние операций модели на граф кариотипа. Сплошные кромки: кромки интервала; пунктирные края: примыкания; номера по краям: CN; знаки молнии: точки останова. Нарисованные линии показывают путь, затронутый операцией.Последовательности генов, соответствующие возможным хромосомам, показаны под каждым графиком, причем каждая хромосома выделена отдельной строкой. Гены a, b, c, d соответствуют сегментам на крайнем левом графике кариотипа сверху вниз.
Путь с чередованием — это простой путь в G , в котором нечетные кромки являются кромками интервала, а четные кромки — кромками смежности или наоборот.
Хромосома в кариотипе представляет собой чередующийся путь, начинающийся и заканчивающийся теломерами.Обратите внимание, что кариотип может быть разложен на хромосомы несколькими способами.
2.2 Модель
Теперь мы переходим к определению возможных операций, которые изменяют кариотип в нашей модели (сравните Рис. 1).
DCJ : операция DCJ выбирает два ребра смежности (a, b), (c, d) , удаляет копию каждого из графа и добавляет копии новых ребер путем соединения двух свободных концов либо ( a, c), (b, d) или (a, d), (b, c) . Для поддержки расщепления хромосомы и введения дополнительных копий теломер мы также допускаем особый случай DCJ, называемый Single-cut-and-join ( SCJ ).SCJ отсекает существующую смежность ( a , b ) и соединяет каждый свободный конец с новой копией теломер t1, t2∈T. Результатом этого SCJ является (a, t1), (b, t2) , то есть разделение смежности на две отдельные хромосомы, покрытые новыми копиями теломер t 1 , t 2 . Обратите внимание, что SCJ создают новые копии теломер, которые могут быть, а могут и не быть частью окончательного кариотипа. Идентичность каждого t i может быть выбрана произвольно.
Тандемное дублирование : Пусть v1,…, v2m будет чередующимся путем без теломер, начинающихся с края интервала.Тандемное дублирование добавляет копии ребер для каждого ребра в пути и добавляет еще одну копию ребра смежности (v1, v2m) . Мы называем v1, v2m якорями дублирования. В терминах последовательности эта операция соответствует… g0g1g2… gm − 1gm¯gm + 1… →… g0g1g2… gm − 1gm¯g1g2… gm − 1gm¯gm + 1… где g i — ген, соответствующий в узел v2i − 1.
Дублирование хромосомы : Пусть t0, v1,…, v2m, t2m + 1 будет чередующимся путем, так что t0, t2m + 1 — теломерные конечности, а ( v 1 , v 2 ) — край интервала.Дупликация хромосомы добавляет краевые копии для каждого края вдоль пути и увеличивает CN двух теломер на единицу.
Сегментное удаление : Пусть v1,…, v2m будет чередующимся путем без теломер, начинающихся с ребра смежности. Сегментарное удаление удаляет копии ребер для каждого ребра вдоль пути и добавляет копию ребра смежности (v1, v2m) . Мы называем v1, v2m привязками удаления. В терминах последовательности эта операция соответствует… g0g1g2… gm − 1gm¯gm + 1… →… g0g1gm¯gm + 1… .
Делеция хромосомы : это особый случай сегментарной делеции, где v 1 и v2m являются теломерными узлами. Мы не добавляем ребро (v1, v2m), и это соответствует удалению всей хромосомы с ее теломерами.
Задача сортировки кариотипов : входные данные: S , T , d , где S = (s_cn, s_adj) — исходный кариотип, T = (t_cn, t_adj) — целевой кариотип, а d — целое число.Наша цель — найти кратчайшую серию из ≤d операций, преобразующих S в T , или объявить, что такой последовательности не существует. Пример серии операций длиной 11 приведен на рисунке 3.
Обратите внимание, что задача сортировки не является симметричной. Более того, может быть сценарий сортировки от S до T , но не от T до S , если, например, T потерял все копии некоторого сегмента в S .Новый материал можно получить в модели путем дупликаций (тандемных и хромосомных). Теломеры также могут быть получены с помощью SCJ.
Теорема 1 . Задача сортировки кариотипа является NP-сложной.
Доказательство. Пусть G = (V, E) — ориентированный граф с n узлами, в котором все внутренние и внешние степени равны 2. Решить, содержит ли такой граф гамильтонов цикл, является NP-трудным (PlesńIk, 1979). Пусть (y, x) ∈E — некоторое ребро. Решить, существует ли гамильтонов путь от x до y в G , все еще сложно.Мы предполагаем, что w.l.o.g. что G сильно связан, поскольку в противном случае он не содержал бы гамильтонова траектория от x до y . Обратите внимание, что в этом случае G также является эйлеровым.
Мы конструируем исходный кариотип S следующим образом: для каждого узла в v∈V мы создаем ген g v с CN = 2 и для каждого (u, v) ∈E ∖ {(y, x )} добавляем одну копию смежности (guh, gvt) . Кроме того, мы добавляем два гена w , z с CN = 1 и соединяем их смежностями (wh, gxt), (gyh, zt) CN = 1.Чтобы сделать его действительным кариотипом, мы добавляем левую и правую теломеры t 1 , t 2 и соединяем их с w t и z h соответственно. Другими словами, S — это кариотип с одной хромосомой t1, w, x, Pe, y, z, t2, где P e соответствует некоторому эйлерову пути от x до y в G . Наш целевой кариотип T будет состоять из n хромосом с одним геном формы t1, gv, t2 и дополнительной хромосомы t1, w, z, t2.А именно, каждый ген будет иметь CN = 1, для теломер CN = n + 1, а примыкания будут иметь форму (t1, gvt) и (gvt, t2) для v∈V plus (t1, wt), (wh, zt), (zh, t2) . Обратите внимание, что все хромосомные пути начинаются и заканчиваются одними и теми же теломерами t 1 , t 2 . Мы покажем, что существует сценарий сортировки от S до T длины n + 1 тогда и только тогда, когда G допускает гамильтонов путь от x до y .
Предположим, что G содержит гамильтонов путь P = x, v2,…, vn − 1, y. Чтобы построить сценарий сортировки, сначала выполните n SCJ для каждой смежности формы (guh, gvt), которая не является частью P , и соедините их как (t1, gvt) и (gut, t2) . Теперь выполните сегментное удаление пути gx, gv2,…, gvn − 1, gy, соединяющего w h и z t . Общая длина сценария сортировки составляет n + 1.
Для другого направления предположим, что существует сценарий сортировки с операциями n + 1 от S до T .Поскольку каждый ген в T имеет CN = 1, сценарий должен содержать по крайней мере одну делецию. Обратите внимание, что T имеет n дополнительных копий теломер, и единственный способ увеличить CN теломер в модели — это либо дупликация хромосомы, либо SCJ. Однако каждая дупликация хромосомы потребует дополнительных делеций для уменьшения CN гена до 1 в T . Мы пришли к выводу, что сценарий сортировки должен содержать n SCJ и одну делецию, охватывающую все гены g v .Поскольку w и z смежны в T , сегментное удаление должно быть привязано к w h и z t . Обозначим путь этого удаления P = gx, gv2,…, gvn − 1, gy. Соответствующий путь P ′ = x, v2,…, vn − 1, y является гамильтоновым путем в G . □
2.3 Составление ПДОДИ
Мы представляем формулировку ILP для задачи сортировки кариотипов. Формулировка описывает d + 1 графов кариотипа G0,… Gd, соответствующих геному после каждой операции. G 0 устанавливается на S и Gd = T. Формулировка гарантирует, что разница между последовательными графиками соответствует одной действующей операции модели.
2.3.1 Переменные
Мы определяем целочисленные переменные для каждого G k следующим образом. Для каждого k∈ [0, d] и каждого i∈G пусть cnik∈ℕ будет переменной для CN гена i после k операций. По определению cni0 = s_cni и cnid = t_cni для каждого i∈G.Точно так же для каждого k∈ [0, d] и каждого u, v∈E пусть adju, vk будет CN ребра смежности ( u , v ) после k операций. По определению adju, v0 = s_adju, v и adju, vd = t_adju, v для каждого u, v∈E.
Теперь мы определяем двоичные переменные для каждого типа операции. Для каждого k∈ [0, d] и каждого u, v∈E пусть cutu, vk∈ {0,1} будет индикаторной переменной для сокращения интервальной смежности между u и v в k ‘-м операция. Точно так же joinu, vk — это индикаторная переменная для соединения двух оконечностей и и v в операции k ‘.По соглашению, разрез и соединение не являются симметричными, чтобы обеспечить возможность двойного разрезания или объединения одной и той же смежности. SCJ — это DCJ с одной существующей смежностью и неявной смежностью теломер. Для поддержки операций SCJ для каждых двух теломер t1≤t2∈T вводятся двоичные переменные addTelt1, t2k. addTelt1, t2k = 1 означает, что создаются новые копии теломер t1, t2∈T.
Для каждого k∈ [0, d] и каждого u≤v∈E * пусть ampAnchu, vk∈ {0,1} будет индикаторной переменной для тандемного дублирования, начиная с и и заканчивая v в к -я эксплуатация.Кроме того, переменная ampAncht1, t2k∈ {0,1} для t1≤t2∈T указывает на амплификацию хромосомы для хромосомы, начинающейся и заканчивающейся на теломерах t 1 и t 2 соответственно. Пусть ampGeneik∈ {0,1} будет индикаторной переменной, которая определяет ген i [т.е. край интервала (it, ih)] является частью дублированного сегмента, и пусть ampAdju, vk∈ {0,1} будет индикаторной переменной, что край смежности ( u , v ) является частью дублированный сегмент.
Аналогично, для каждого k∈ [0, d] и каждого u≤v∈E delAnchu, vk∈ {0,1} является индикаторной переменной для удаления, начиная с и и заканчивая v в к -я эксплуатация. delGeneik∈ {0,1} — индикаторная переменная, что ген i является частью удаленного сегмента, а delAdju, vk∈ {0,1} — индикаторная переменная, граница смежности ( u , v ) является частью удаленного сегмента.
2.3.2 Ограничения
Теперь мы опишем ограничения ILP для каждого этапа 0≤k≤d − 1.Мы опишем ограничения для каждого типа операции и общие ограничения для обновления графа кариотипа.
Обновление кариотипов : CN нетеломерного гена i∈G * увеличивается за счет амплификаций и уменьшается за счет делеций:
cnik + 1 = cnik + ampGeneik − delGeneik
Для теломерного гена i∈TG с соответствующей конечностью t ∈T, CN может увеличиваться, если новые копии теломер вводятся через SCJ. SCJ может добавить либо две копии одной и той же теломеры, либо одну копию двух теломер:
cnik + 1 = cnik + ampGeneik − delGeneik + 2addTelt, tk + ∑t ′ ≠ t∈TaddTelt, t′k
Обновление CN смежности для внутренних узлов u ≠ v∈E * :
adju, vk + 1 = adju, vk + ampAnchu, vk + ampAdju, vk + delAnchu, vk
−delAdju, vk − cutu, vk − cutv, uk + joinu, vk + joinv , uk
(1)
На словах, мы увеличиваем CN смежности, если это либо привязка дублирования, вдоль пути дублирования, привязка удаления или его концы соединяются.Смежность CN уменьшается, если она находится на пути удаления или обрезана. Переменная вырезания и соединения может уменьшать или увеличивать CN максимум на 2, если одна и та же смежность используется дважды в DCJ.
Обновление смежности CN для краев цикла ( u , u ) аналогично уравнению (1), но использует только одиночные переменные cutu, uk, joinu, uk.
Для теломер t∈T и внутреннего узла v∈E * мы обновляем CN следующим образом:
adjt, vk + 1 = adjt, vk + ampAdjt, vk + delAncht, vk − delAdjt, vk
Кроме того, мы требуем, чтобы в на каждом этапе k будет не более одной операции:
12∑u, v∈Ecutu, vk + ∑u≤v∈E * ampAnchu, vk + ∑u≤v∈EdelAnchu, vk
+ ∑t1≤t2∈TampAnchu , vk≤1
DCJ : смежность не может быть сокращена больше раз, чем ее CN.Следовательно, для любых u∈E, v∈E и u ≠ v:
cutu, vk + cutv, uk≤adju, vk
Аналогично для смежностей вида ( u , u ): cutu, uk≤adju, uk.
Для каждой смежности u∈E количество разрезов равно количеству объединений:
∑v∈Ecutu, vk + ∑v∈Ecutv, uk = ∑v∈Ejoinu, vk + ∑v∈Ejoinv, uk
Для каждой пары теломер t1≤t2∈T, SCJ вводит явную смежность ( t 1 , t 2 ), которая сразу же отсекается как часть DCJ: Кроме того, если t1
Амплификации : ген i∈G не может быть амплифицирован, если он имеет CN = 0 : Аналогично, смежность u, v∈E может быть усилена только в том случае, если она имеет положительный CN: для каждого внутреннего узла u∈E * соответствующий ему ген усиливается тогда и только тогда, когда усиливается одно из его смежностей или это якорь усиления:
ampGeneg (u) k = ∑v∈E * ampAnchu, vk + ∑v∈EampAdju, vk.
Теломеры t∈T могут участвовать только в дупликациях целых хромосом. Следовательно, теломер усиливается, если он является якорем, если и только если усиливается одно из его смежностей:
ampGeneg (t) k = ∑t′∈TampAncht, t′k = ∑v∈E * ampAdjt, vk
Обеспечение связности путей : Одна проблема с этой формулировкой заключается в том, что в дополнение к пути усиления мы можем получить набор непересекающихся циклов, состоящих из чередующихся интервалов и ребер смежности с соответствующими им переменными ampGeneg (u) k, ampAdju, vk, установленными в единицу.Например, рассмотрим S = 1,1,2,2 и T = 1,1,1,2,2,2. Чтобы перейти от S к T , нам нужно сделать две тандемные дупликации генов 1 и 2. Однако, согласно текущей формулировке, это можно сделать за один шаг, присвоив ampGene10 = 1, ampGene20 = 1, ampAnch2t. , 1h0 = 1, ampAdj2t, 2t0 = 1.
Чтобы заставить альтернативный путь усиления быть подключенным, мы добавляем ограничения в виде потока (Bruckner et al. , 2010). Предположим, что q > r являются якорями усиления и обозначим r как приемник .Каждый узел на пути от q до r (исключая r ) будет как источник одной единицы потока, и мы требуем, чтобы весь поток в конечном итоге дренировался при r . Это обеспечивает связность пути.
Пусть −2 (n + 1) ≤fu, vk≤2 (n + 1) будет целочисленной переменной для направленного количества потока от u∈E к v∈E. Пусть ampNodesk = 2∑i∈GampGeneik будет целочисленной переменной для числа узлов, которые усиливаются по пути. Мы ищем исходные узлы ampNodesk-1, каждый из которых обеспечивает одну единицу потока, и один приемник, который истощает единицы потока ampNodesk-1.Пустьinkvk = ∑u> vampAnchv, uk будет двоичной переменной, указывающей, что v является стоком. У нас есть следующие ограничения:
Поток антисимметричный: fu, vk = −fv, uk.
Ребро может содержать поток, только если он усилен: fu, vk≤2 (n + 1) ampAdju, vk, если u , v не принадлежат к одному и тому же гену, а fu, vk≤2 (n + 1) ampGeneik, если u , v являются узлами гена i .
Производство и сохранение потока в каждом узле u∈E:
∑vfu, vk = ampGeneg (u) k − ampNodesk ·inkuk
По этому ограничению, если u не является частью пути усиления, мы имеем ∑vfu , vk = 0.Если и являются частью тракта усиления, но не стоком, мы имеем ∑vfu, vk = 1, то есть и добавляют к потоку одну единицу. Если и является частью пути усиления и приемника, у нас есть ∑vfu, vk = 1 − ampNodesk, и он истощает весь поток. Поскольку термин ampNodesk ·inkuk не является линейным, мы вводим новую неотрицательную целочисленную переменную productuk таким образом, что productuk = ampNodesk ·inkuk с использованием следующих ограничений:
productuk≤2 (n + 1) ·inkuk
ampNodesk − 2 (n + 1) (1 −inkuk) ≤productuk
Если ampNodesk = 0 илиINKuk = 0 тогда первые два ограничения вынуждают productuk = 0, в противном случае productuk≤ampNodesk.Если синкук = 1, у нас есть ampNodesk≤productuk и, следовательно, productuk = ampNodesk.
Удаление : гены или смежности не могут быть удалены, если их CN равен нулю. Поэтому мы добавляем ограничение, подобное 2 и 3, используя вместо этого delGeneik и delAdju, vk.
Для каждого внутреннего узла u∈E * одно из его смежностей удаляется тогда и только тогда, когда оно является якорем удаления или его ген удален:
∑v∈EdelAdju, vk = delGeneg (u) k + ∑v∈ E * delAnchu, vk
Теломер t∈T может быть удален, только если он является частью делеции всей хромосомы:
delGeneg (t) k = ∑t′∈TdelAncht, t′k
Если теломер t∈T является привязки сегментного удаления, то одно из его смежностей должно быть удалено:
∑v∈EdelAncht, vk = ∑v∈EdelAdjt, vk
Что касается амплификаций, мы добавляем ограничения потока, чтобы гарантировать, что путь удаления связан.
2.3.3 Целевая функция
Наша цель — минимизировать количество амплификаций, делеций и DCJ:
мин0001≤k≤d (∑t1≤t2∈TampAncht1, t2k + ∑u≤v∈E * ampAnchu, vk +
∑u≤v∈EdelAnchu , vk + 14∑u, v∈E [cutu, vk + joinu, vk])
DCJ имеют два разреза и два соединения и поэтому вносят один вклад в целевую функцию. Целевая функция может быть изменена, чтобы присвоить разные веса различным операциям и даже конкретным событиям, например амплифицирующие области с онкогенами.
2.3.4 Сложность
В целом формулировка ПДОДИ имеет O (dn2) переменных и O (dn2) ограничений. Мы можем ослабить ограничения целочисленности для всех недвоичных переменных, поскольку каждая из них должна быть суммой двоичных переменных.
Поскольку мы не знаем оптимального значения d * для d , мы можем выполнить либо двоичный, либо последовательный поиск на d . Если для каких-то d нет приемлемого решения, увеличиваем d .Если d≥d * , ILP найдет решение с d * операциями, поскольку он всегда может добавлять этапы без операций в них.
Каждый DCJ вводит две новые смежности, в то время как сегментарные делеции и тандемные дупликации вводят одну новую смежность. Тривиальная нижняя граница d — это количество контрольных точек, деленное на два. Тривиальная верхняя граница: d≤∑u≤v∈E | s_adju, v − t_adju, v | + ∑i∈G | s_cni − t_cni | . То есть изменение CN каждого гена и каждой смежности отдельно.
Проблема ILP является NP-сложной (Karp, 1972), и время выполнения алгоритмов ILP не ограничено полиномиально.Однако современные решатели ILP включают мощную эвристику и могут справляться со многими крупномасштабными задачами. ILP стала мощным инструментом в формулировании и решении других моделей перегруппировки (Рахманн и Клау, 2006; Шао и др. , 2015; Шао и Морет, 2015).
3 Результаты
3.1 Моделирование
Для оценки эффективности мы смоделировали кариотипы опухолей и применили к ним алгоритм. Вот обзор моделирования: мы начинаем с диплоидного кариотипа S ‘с двумя идентичными хромосомами 1,…, m и выполняем операции d для получения кариотипа опухоли T′.Затем мы сжимаем максимальные одинаковые сегменты в S ′ и T ′ в одиночные. Полученные более короткие исходный и целевой кариотипы используются в качестве входных данных для алгоритма.
Изначально каждая хромосома представлена последовательностью из m = 100 атомных сегментов. Мы выполняем серию операций на кариотипе, применяя дупликации (тандемные или хромосомные), делеции (сегментарные или хромосомные) и DCJ (инверсии или транслокации). Событиям на всей хромосоме дается низкая вероятность (каждое по 5%), в то время как все другие типы выбираются равномерно случайным образом.Диапазон сегментарных делеций, дупликаций и инверсий был выбран случайным образом и был ограничен 30 единицами, чтобы избежать быстрой потери средних сегментов.
Чтобы уменьшить размер кариотипов, мы сжимаем максимально идентичные последовательности в S ‘и T’. То есть простой путь, который появляется в S ‘и T’, сжимается, если все ребра интервалов и смежности вдоль пути имеют одинаковый CN, а узлы вдоль пути не имеют других ребер ветвления, кроме ребер пути. Результатом являются новые кариотипы S и T с n≤m сегментами.Таким образом, каждый сегмент сжатых кариотипов должен быть задействован как минимум в одной точке останова. Поскольку все операции действуют на смежных путях в графе, а все сегменты внутри сжатого пути симметричны, мы предполагаем, что эта процедура сохраняет оптимальное расстояние. Эта сжатая структура кариотипа соответствует информации, предоставляемой большинством сборочных инструментов, в которых смежные сегменты определяются путем обнаружения контрольных точек.
Мы моделировали кариотипы с помощью трех-восьми операций.Эйтан и Шамир (2017) наблюдали на основе анализа образцов опухолей из Malhotra et al. (2013), что среднее количество операций, наблюдаемых в реальных данных глубокого секвенирования рака, составляло 5–8 на один связанный компонент. Для каждого расстояния было смоделировано 20 экземпляров, и оптимальное расстояние было вычислено алгоритмом. В таблице 1 мы видим, что вычисленное расстояние ограничено смоделированным расстоянием, но иногда может быть короче, когда d увеличивается.
Таблица 1.
Оптимальное количество событий, вычисленное алгоритмом, по сравнению с имитируемым количеством событий
| Моделируемые события . | 1 . | 2 . | 3 . | 4 . | 5 . | 6 . | 7 . | 8 . | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Макс | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5 | 6 | 7 | 7 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| мин. | 1 | 1 | 1 | 2 | 1 | 2 | 3 | 6 | . | 1 . | 2 . | 3 . | 4 . | 5 . | 6 . | 7 . | 8 . | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Макс | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5 | 6 | 7 | 7 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Min | 1 | 1 | 1 | 2 | 1 | 2 | 3 Таблица | 6 |
| Моделируемые события . | 1 . | 2 . | 3 . | 4 . | 5 . | 6 . | 7 . | 8 . | |||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Макс | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | |||||||||||||||||
| 5 | 6 | 7 | 7 | ||||||||||||||||||||||
| мин. | 1 | 1 | 1 | 2 | 1 | 2 | 3 | 6 | . | 1 . | 2 . | 3 . | 4 . | 5 . | 6 . | 7 . | 8 . | ||||||||
| Макс | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | |||||||||||||||||
| 5 | 6 | 7 | 7 | ||||||||||||||||||||||
| Min | 1 | 1 | 1 | 2 | 1 | 2 | 3 |
| Образец . | Компоненты . | Расстояние . | Образец . | Компоненты . | Расстояние . | Образец . | Компоненты . | Расстояние . | |||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| OV1 | (16), (13) | 1 | OV1 | (12, 15) | 3 | OV1 | (11, 20) | OV1 | 5 9110 | (1, 2, 3, 4, 5, 6, 8, 9, 10, 14, 17, 19) | NA | OV2 | (8, 20) | 5 | OV2 | (3 , 4), (9) | 6 | ||||||||
| OV2 | (14, 21) | 10 | OV2 | (12, 16, 18) | 26 | OV2 | (1, 2, 5, 7, 10, 11, 15, 19, 22) | NA | |||||||||||||||||
| OV3 | (13), (17), (21) | 1 | OV3 | (9), (18) | 2 | OV3 | (2) | 6 | |||||||||||||||||
| OV3 | (4, 8) | 7 | OV4 | (1), (13), (20), (21) | (1), (13), (20), (21) | (1), (13), (20), (21) | 1 | OV4 | (18) | 2 | |||||||||||||||
| OV4 | (3), (15) | 6 | OV4 | (22) | 4 | OV4 | (11) | 10 | ), (9, 12) | 11 | OV4 | (5, 10, 16, 19) | 20 | OV4 | (2, 4, 6, 7, 14, 17) | NA | |||||||||
| OV5 | (7), (16) | 1 | OV5 | (1, 3), (2, 17), (9, 10) | 3 | OV5 | (12, 21) , (18) | 4 |
| Образец . | Компоненты . | Расстояние . | Образец . | Компоненты . | Расстояние . | Образец . | Компоненты . | Расстояние . | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| OV1 | (16), (13) | 1 | OV1 | (12, 15) | 3 | OV1 | (11, 20) | OV1 | 5 9110 | (1, 2, 3, 4, 5, 6, 8, 9, 10, 14, 17, 19) | NA | OV2 | (8, 20) | 5 | OV2 | (3 , 4), (9) | 6 | |
| OV2 | (14, 21) | 10 | OV2 | (12, 16, 18) | 26 | OV2 | (1, 2, 5, 7, 10, 11, 15, 19, 22) | NA | ||||||||||
| OV3 | (13), (17), (21) | 1 | OV3 | (9), (18) | 2 | OV3 | (2) | 6 | ||||||||||
| OV3 | (4, 8) | 7 | OV4 | (1), (13), (20), (21) | (1), (13), (20), (21) | (1), (13), (20), (21) | 1 | OV4 | (18) | 2 | ||||||||
| OV4 | (3), (15) | 6 | OV4 | (22) | 4 | OV4 | (11) | 10 | 11 | OV4 | (5, 10, 16, 19) | 20 | OV4 | (2, 4, 6, 7, 14, 17) | NA | |||
| OV5 | (7), (16) | 1 | OV5 | (1, 3), (2, 17), (9, 10) | 3 | OV5 | (12, 21) , (18) | 4 |
Таблица 2.
Результаты алгоритма на образцах яичников TCGA
| Образец . | Компоненты . | Расстояние . | Образец . | Компоненты . | Расстояние . | Образец . | Компоненты . | Расстояние . | |||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| OV1 | (16), (13) | 1 | OV1 | (12, 15) | 3 | OV1 | (11, 20) | OV1 | 5 9110 | (1, 2, 3, 4, 5, 6, 8, 9, 10, 14, 17, 19) | NA | OV2 | (8, 20) | 5 | OV2 | (3 , 4), (9) | 6 | ||||||||
| OV2 | (14, 21) | 10 | OV2 | (12, 16, 18) | 26 | OV2 | (1, 2, 5, 7, 10, 11, 15, 19, 22) | NA | |||||||||||||||||
| OV3 | (13), (17), (21) | 1 | OV3 | (9), (18) | 2 | OV3 | (2) | 6 | |||||||||||||||||
| OV3 | (4, 8) | 7 | OV4 | (1), (13), (20), (21) | (1), (13), (20), (21) | (1), (13), (20), (21) | 1 | OV4 | (18) | 2 | |||||||||||||||
| OV4 | (3), (15) | 6 | OV4 | (22) | 4 | OV4 | (11) | 10 | ), (9, 12) | 11 | OV4 | (5, 10, 16, 19) | 20 | OV4 | (2, 4, 6, 7, 14, 17) | NA | |||||||||
| OV5 | (7), (16) | 1 | OV5 | (1, 3), (2, 17), (9, 10) | 3 | OV5 | (12, 21) , (18) | 4 |
| Образец . | Компоненты . | Расстояние . | Образец . | Компоненты . | Расстояние . | Образец . | Компоненты . | Расстояние . | |||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| OV1 | (16), (13) | 1 | OV1 | (12, 15) | 3 | OV1 | (11, 20) | OV1 | 5 9110 | (1, 2, 3, 4, 5, 6, 8, 9, 10, 14, 17, 19) | NA | OV2 | (8, 20) | 5 | OV2 | (3 , 4), (9) | 6 | ||||||||
| OV2 | (14, 21) | 10 | OV2 | (12, 16, 18) | 26 | OV2 | (1, 2, 5, 7, 10, 11, 15, 19, 22) | NA | |||||||||||||||||
| OV3 | (13), (17), (21) | 1 | OV3 | (9), (18) | 2 | OV3 | (2) | 6 | |||||||||||||||||
| OV3 | (4, 8) | 7 | OV4 | (1), (13), (20), (21) | (1), (13), (20), (21) | (1), (13), (20), (21) | 1 | OV4 | (18) | 2 | |||||||||||||||
| OV4 | (3), (15) | 6 | OV4 | (22) | 4 | OV4 | (11) | 10 | ), (9, 12) | 11 | OV4 | (5, 10, 16, 19) | 20 | OV4 | (2, 4, 6, 7, 14, 17) | NA | |||||||||
| OV5 | (7), (16) | 1 | OV5 | (1, 3), (2, 17), (9, 10) | 3 | OV5 | (12, 21) , (18) | 4 |
4 Выводы
В этом исследовании мы представляем модель для сортировки кариотипа с использованием делеций, амплификаций, транслокаций и инверсий.Эта модель поддерживает как структурные, так и числовые изменения, наблюдаемые в геномах рака. Он ориентирован на поиск последовательности операций между двумя кариотипами и позволяет повторно использовать точки останова. Мы показываем, что проблема сортировки является NP-сложной, и разрабатываем формулировку ILP, которая может найти кратчайшую последовательность событий, которые трансформируют нормальный геном в опухолевый. Мы применяем алгоритм к моделированным кариотипам, а также к реальным данным рака яичников. Алгоритм способен решить большинство компонентов реальных геномов опухоли.
Алгоритм имеет ограниченную применимость к очень сложным кариотипам. Как показано на смоделированных данных (рис. 2), время работы растет экспоненциально с количеством операций. Дополнительная работа над формулировкой ПДОДИ может сделать этот подход более практичным. На реальных данных кариотипа алгоритм не смог разрешить несколько чрезвычайно перестроенных связанных компонентов хромосом. Тем не менее, типичные образцы рака демонстрируют умеренную сложность, что делает этот алгоритм полезным в большинстве реальных случаев (Eitan and Shamir, 2017).Более того, сильно перестроенный кариотип может быть результатом зашумленных считываемых данных, неоднородности опухоли или немоделированных глобальных событий. Для решения этих проблем необходимы более эффективные методы.
Хотя модель предназначена для относительно широкого круга операций, она все же имеет некоторые ограничения. Например, наши операции копирования и удаления ограничиваются простыми путями с одной копией каждого сегмента. Однако в некоторых сценариях мы можем извлечь выгоду из выполнения операций на непростых путях. Например, для одного сегмента с м тандемных повторений наша модель потребует м тандемных дубликатов, но только операций log m будет достаточно, если мы разрешим непростое дублирование пути.Другие события, такие как нетандемные сегментарные дупликации и БОС (Zakov et al. , 2013), не включены (но могут быть выражены, например, дополнительный рис. S6) в модели.
Наши кариотипы представлены с использованием их CN и смежности, но это представление не является уникальным для определенного набора хромосом. То есть может быть несколько наборов хромосом, которые могут давать один и тот же кариотип. Поскольку мы не моделируем хромосомы явно, некоторые операции могут быть искусственными и не соответствовать операциям с последовательностями.
Чтобы применить наш метод к большему количеству данных о раке, мы намерены еще больше сократить время выполнения. Затем более систематическое использование алгоритма на большем наборе кариотипов может выявить последовательность операций, общих для нескольких опухолей. Кроме того, алгоритм может вывести последовательность операций между двумя опухолевыми геномами (например, в разные моменты времени) и, таким образом, помочь понять эволюцию опухолей.
В конечном итоге мы хотели бы изобразить сами хромосомы и провести с ними все операции.Целью в этом случае было бы разложить исходный и целевой кариотипы на хромосомы так, чтобы количество операций между ними было минимальным. Тем не менее, недавно утверждалось, что восстановление точных раковых хромосом остается сложной задачей (Eitan and Shamir, 2017).
Благодарность
Авторы благодарят Layla Oesper за предоставленные предварительно обработанные данные о раке яичников и Nimrod Rappoport за полезные комментарии.
Финансирование
Это исследование было частично поддержано Мемориальным фондом Беллы Вальтер Израильской онкологической ассоциации и Фондом Лена Блаватника и семьи Блаватник.Р.З. был поддержан стипендией Центра биоинформатики Эдмонда Дж. Сафры при Тель-Авивском университете.
Конфликт интересов : не объявлен.
Список литературы
Abo
R.P.
(
2015
)
BreaKmer: обнаружение структурных вариаций в целевых данных массового параллельного секвенирования с использованием kmers
.
НАР
,
43
,
e19
—
e19
.
Бадер
М.
(
2010
)
Перестройки генома с дупликациями
.
BMC Bioinformatics
,
11
,
S27.
Bafna
V.
,
Pevzner
P.
(
1996
) Перестройки генома и сортировка путем инверсий.
SIAM J. Comput.
,
25
,
272
—
289
.
Bell
D.
et al. (
2011
)
Комплексный геномный анализ рака яичников
.
Природа
,
474
,
609
—
615
.
Bergeron
A.
et al. (
2006
) Единый взгляд на перестройки генома. In:
Bücher
P.
,
Moret
B.M.
(ред.)
Алгоритмы в биоинформатике
, Vol.
4175
из LNCS.
Springer
,
Берлин, Гейдельберг
, стр.
163
—
173
.
Брукнер
С.
et al. (
2010
)
Запросы сетей взаимодействия белков без топологии
.
JCB
,
17
,
237
—
252
.
Чоудхури
S.A.
et al. (
2014
)
Алгоритмы для совместного моделирования единичного гена, единственной хромосомы и общего числа копий генома в филогенетике опухолей
.
PLoS Comp. Био
.,
10
,
e1003740.
Чириелло
г.
et al. (
2013
)
Новый ландшафт онкогенных признаков рака человека
.
Нац. Genet
.,
45
,
1127
—
1133
.
da Silva
P.H.
et al. (
2012
)
Ограниченная модель DCJ-indel: сортировка линейных геномов с помощью DCJ и indels
.
BMC Bioinformatics
,
13
,
S13.
Ding
L.
et al. (
2014
)
Расширение набора вычислительных инструментов для анализа геномов рака
.
Нац. Ред. Genet
.,
15
,
556
—
570
.
Eitan
R.
,
Shamir
R.
(
2017
)
Реконструкция кариотипов рака по данным краткого считывания: наполовину пустой и наполовину полный стакан
.
BMC Bioinformatics
,
18
,
488.
Feijão
P.
,
Meidanis
J.
(
2011
)
SCJ: расстояние, подобное точке останова, которое упрощает некоторые проблемы перегруппировки
.
TCBB
,
8
,
1318
—
1329
.
Филдинг
А.К.
(
2010
)
Текущее лечение острого лимфобластного лейкоза с положительной филадельфийской хромосомой
.
Haematologica
,
95
,
8
—
12
.
Гринман
C.D.
et al. (
2012
)
Оценка филогении реаранжировки раковых геномов
.
Genome Res
.,
22
,
346
—
361
.
Справочное руководство по оптимизатору Gurobi, Gurobi Optimization
. (
2018
).
Hannenhalli
S.
,
Pevzner
P.A.
(
1996
) Превращение людей в мышей (полиномиальный алгоритм для проблемы геномного расстояния). В:
Proceedings of FOCS
, Vol.
36
, стр.
581
—
592
. IEEE.
Hannenhalli
S.
,
Pevzner
P.A.
(
1999
) Преобразование капусты в репу: полиномиальный алгоритм сортировки перестановок со знаком по разворотам.
J. ACM
,
46
,
1
—
27
.
Карп
Р.М.
(
1972
)
Сводимость среди комбинаторных задач
.
Springer US
,
Бостон, Массачусетс
, стр.
85
—
103
.
Корбель
J.O.
et al. (
2007
)
Картирование парных концов выявляет обширные структурные вариации в геноме человека
.
Наука
,
318
,
420
—
426
.
Malhotra
A.
et al. (
2013
)
Профилирование точек разрыва 64 геномов рака выявляет многочисленные сложные перестройки, порожденные независимыми от гомологии механизмами
.
Genome Res
.,
23
,
762
—
776
.
Ng
C.K.
et al. (
2012
)
Роль фенотипа тандемного дупликатора в эволюции опухоли при тяжелом серозном раке яичников
.
Дж. Патол
.,
226
,
703
—
712
.
Oesper
L.
et al. (
2012
)
Реконструкция геномов рака по данным парного секвенирования
.
BMC Bioinformatics
,
13 (Приложение 6)
,
S10.
Озеры-Флато
М.
,
Шамир
р.
(
2009
)
Сортировка кариотипов рака по элементарным операциям
.
JCB
,
16
,
1445
—
1460
.
Pevzner
P.
,
Tesler
G.
(
2003
)
Геномные последовательности человека и мыши обнаруживают многократное повторное использование контрольных точек в эволюции млекопитающих
.
PNAS
,
100
,
7672
—
7677
.
Плешник
J.
(
1979
)
NP-полнота проблемы гамильтонова цикла в плоских орграфах со степенью два
.
Инф. Процесс. Lett
.,
8
,
199
—
201
.
Rahmann
S.
,
Klau
G.W.
(
2006
) Целочисленные линейные программы для обнаружения приблизительных кластеров генов. В:
Proceedings of WABI
, Vol.
4175
из LNCS.
Springer
,
Berlin Heidelberg
, p
p. 298
—
309
.
Raphael
B.J.
et al.(
2003
)
Реконструкция архитектуры генома опухоли
.
Биоинформатика
,
19
,
ii162
—
ii171
.
Schwarz
R.F.
et al. (
2014
)
Филогенетическая количественная оценка внутриопухолевой гетерогенности
.
PLoS Comp. Био
.,
10
,
e1003535.
Shao
M.
,
Lin
Y.
(
2012
)
Приблизительное расстояние редактирования для геномов с повторяющимися генами в DCJ, вставка и делеция
.
BMC Bioinformatics
,
13
,
S13.
Shao
M.
,
Moret
B.M.E.
(
2015
)
Сравнение геномов с перестройками и сегментарными дупликациями
.
Биоинформатика
,
31
,
i329
—
i338
.
Shao
M.
et al. (
2015
)
Точный алгоритм для вычисления двойного разрезания и соединения для геномов с повторяющимися генами
.
JCB
,
22
,
425
—
435
.
Tannier
E.
et al. (
2009
)
Проблемы мультихромосомной медианы и деления пополам при разных геномных расстояниях
.
BMC Bioinformatics
,
10
,
120.
Vogelstein
B.
et al. (
2013
)
Пейзажи генома рака
.
Наука
,
339
,
1546
—
1558
.
Янкопулос
S.
et al. (
2005
)
Эффективная сортировка геномных перестановок путем транслокации, инверсии и блочного обмена
.
Биоинформатика
,
21
,
3340
—
3346
.
Заков
S.
et al. (
2013
)
Алгоритмический подход для обнаружения мостов разрыва-слияния в геномах опухолей
.
PNAS
,
110
,
5546
—
5551
.
Zeira
R.
,
Shamir
R.
(
2017
)
Сортировка по разрезам, соединениям и дупликациям целых хромосом
.
JCB
,
24
,
127
—
137
.
Zeira
R.
et al. (
2017
)
Алгоритм линейного времени для задачи преобразования числа копий
.
JCB
,
24
,
1179
—
1194
.
© Автор (ы) 2018.Опубликовано Oxford University Press. Все права защищены. Для получения разрешений обращайтесь по электронной почте: [email protected]
Наследственная реконструкция кариотипов показывает исключительную скорость неслучайной хромосомной эволюции у подсолнечника
ОРГАНИЗМЫ широко различаются по количеству и расположению своих хромосом, то есть , их кариотип. Интересно, что кариотипические различия часто связаны с границами видов и, следовательно, предполагают связь между хромосомной эволюцией и видообразованием (White 1978; King 1993).Действительно, хорошо известно, что хромосомные перестройки могут способствовать репродуктивной изоляции. Люди, гетерозиготные по дивергентным кариотипам, часто бесплодны или неуязвимы (King 1987; Lai et al. 2005; Stathos and Fishman 2014). Помимо непосредственного воздействия на стерильность и инвазивность гибридов, хромосомные перестройки могут также способствовать развитию других репродуктивных барьеров за счет расширения участков генома, защищенных от интрогрессии (Noor et al. 2001; Rieseberg 2001), накопления генетической несовместимости (Navarro and Barton 2003). ) и упрощение подкрепления (Трикетт и Батлин, 1994).Несмотря на его распространенность и потенциально важную роль в видообразовании, общие закономерности кариотипической дивергенции все еще недостаточно изучены. Картирование и характеристика хромосомных перестроек во многих таксонах — важный шаг к пониманию их эволюционной динамики.
Изучение эволюции хромосом в любой группе требует генетических карт высокой плотности. Недавно Barb et al. (2014) построил генетические карты высокой плотности для видов подсолнечника Helianthus niveus ssp. tephrodes и H. argophyllus и сравнили их с H. annuus . Этот анализ точно отобразил ранее предполагаемые кариотипы (Heiser 1951; Chandler et al. 1986; Quillet et al. 1995), но уловил лишь небольшую часть хромосомных вариаций однолетних подсолнечников. Например, сравнение генетических карт с ограниченной плотностью маркеров позволяет предположить, что несколько хромосомных перестроек отличают H. petiolaris от H.annuus (Rieseberg et al. 1995; Burke et al. 2004), а данные цитологических исследований позволяют предположить, что подвиды в пределах подвида H. petiolaris несут дивергентные кариотипы (Heiser 1961). Добавление генетических карт с высокой плотностью подвидов H. petiolaris к Barb et al. Анализ (2014) позволит нам: (1) точно отслеживать дополнительные перестройки, (2) реконструировать наследственные кариотипы для группы и (3) распутать перекрывающиеся перестройки, которые можно скрыть путем прямого сравнения современных кариотипов.
Другой важной частью многовидового сравнительного исследования эволюции хромосом с использованием данных генетической карты является систематический и повторяемый метод идентификации синтенных хромосомных областей ( sensu Pevzner and Tesler 2003). Эти методы особенно важны для случаев с высокой плотностью маркеров, потому что точки разрыва между блоками синтении могут быть размыты из-за ошибок отображения, микроупорядочения и паралогии (Hackett and Broadfoot 2003; Choi et al. 2007; Barb et al. 2014; Bilton et al. 2018). В предыдущих исследованиях блоки синтении были обнаружены различными методами ad hoc , включая подсчет всех различий в порядке маркеров (Wu and Tanksley, 2010), путем визуального осмотра (Burke et al. 2004; Marone et al. 2012; Latta et al. 2019), или вручную применяя простые правила, такие как пороговые значения размера (Heesacker et al. 2009; Barb et al. 2014; Rueppell et al. 2016) и сравнения рангов Спирмена (Бердан и др. 2014; Schlautman et al. 2017). Однако эти методы становятся трудноразрешимыми и подверженными ошибкам при применении к очень плотным генетическим картам. Кроме того, насколько нам известно, не существует доступного программного обеспечения, которое идентифицирует блоки синтении только на основе относительных положений маркеров (, т.е. , без необходимости использования эталонных геномов, данных последовательностей или маркеров с известной ориентацией).
Здесь, с целью понимания эволюции хромосом у Helianthus и в более общем плане, мы стремились: (1) построить генетические карты с высокой плотностью для двух подвидов H.petiolaris , (2) разработать метод и программное обеспечение для систематической и повторяемой идентификации блоков синтении из любого количества парных позиций на генетической карте, (3) реконструировать наследственные кариотипы для части однолетних подсолнухов и (4) выявить общие закономерности хромосомной перестройки в Helianthus .
Материалы и методы
Система исследования
Мы сосредоточили внимание на пяти близкородственных диплоидных (2 n = 34) таксонах из однолетней клады рода Helianthus (рис. 1).Эти подсолнухи произрастают в Северной Америке (дополнительный материал, рисунок S1; Rogers et al. 1982) и по своей природе самонесовместимы (одомашненные линии H. annuus самосовместимы). H. annuus встречается на большей части территории центральных штатов США, часто на довольно тяжелых почвах и вдоль обочин (Heiser 1947). H. petiolaris встречается на более песчаных почвах и состоит из двух подвидов: H. petiolaris ssp. petiolaris , который обычно встречается на юге Великих равнин, и H.petiolaris ssp. fallax , который ограничен более засушливыми регионами в Колорадо, Юте, Нью-Мексико и Аризоне (Heiser 1961). Там, где H. petiolaris и H. annuus являются симпатрическими, между видами происходит обмен генами (Strasburg and Rieseberg 2008). H. argophyllus в основном встречается на восточном побережье Техаса, где он также перекрывается и гибридизируется с H. annuus (Baute et al. 2016). Наконец, H. niveus ssp. тефроды — факультативное многолетнее растение, которое растет в дюнах от юго-западных штатов США до Мексики.
Рисунок 1
Таксоны подсолнечника, использованные в этом исследовании. (A) Филогенетические отношения, основанные на Stephens et al. (2015) и Baute et al. (2016). (B) H. niveus подвид. тефроды . (C) H. petiolaris подвид. петиолярис . (D) H. petiolaris подвид. Фаллоимитатор . (E) H. argophyllus .(F) H. annuus . Фото: Брук Мойерс (B, C, E и F) и Роуз Эндрю (D).
Контролируемые скрещивания
Для создания генетических карт мы скрестили беспородную особь с предположительно высокой гетерозиготностью от каждого подвида H. petiolaris с гомозиготной инбредной линией одомашненного подсолнечника и генотипировали полученное потомство F1. Этот тест-кросс-дизайн позволяет нам сделать вывод, где произошла рекомбинация у гетерозиготных родителей, потому что мы можем надежно отслеживать сегрегацию аллелей этих родителей на предсказуемом фоне (рис. 2).
Рисунок 2
Диаграмма, показывающая, как тестовое скрещивание может быть использовано для картирования событий рекомбинации у аутбредной особи, которая может (А) или не может (В) разделять аллели с инбредной линией. Каждая линия представляет собой хромосому, а цвета представляют родословную.
В частности, мы использовали пыльцу одного вида H. petiolaris ssp. petiolaris (PI435836) и единственное растение H. petiolaris ssp. fallax (PI435768) для оплодотворения особей высокоинбредной и мужской стерильной линии H.annuus (HA89cms). Самонесовместимые образцы H. petiolaris были собраны в центральном Колорадо (PI435836, 39,741 °, -105,342 °, округ Боулдер) и в юго-восточном углу штата Нью-Мексико (PI435768, 32,3 °, -104,0 °, округ Эдди; Рисунок S1. ), и поддерживалось Министерством сельского хозяйства США для крупных популяций. Когда он был первоначально собран, образец PI435768 был классифицирован как H. neglectus . Однако на основании местонахождения коллекции (Heiser 1961) и более позднего генетического анализа шкалы различий между H.petiolaris ssp. fallax и H. neglectus (Raduski et al. 2010), мы считаем, что этот образец следует отнести к H. petiolaris ssp. Соловьева .
Генотипирование
Мы собрали ткань листьев 116 H. annuus × H. petiolaris ssp. petiolaris F1 сеянцы и 132 H. annuus × H. petiolaris ssp. fallax F1 саженцы. Мы экстрагировали ДНК с использованием модифицированного протокола CTAB (Doyle and Doyle, 1987) и подготовили библиотеки генотипирования путем секвенирования (GBS) с индивидуальным штрих-кодом, используя версию программы Poland et al.Протокол (2012). Наш модифицированный протокол включает шаги по снижению частоты высококопийных фрагментов (, например, , хлоропластные и повторяющиеся последовательности) на основе Шагина et al. (2010) и Матвиенко и др. (2013), а также шаги по выбору конкретных размеров фрагментов для секвенирования [полный протокол см. В приложении B в Ostevik (2016)].
Вкратце, мы переваривали 100 нг ДНК от каждого человека рестрикционными ферментами ( Pst I-HF или Pst I-HF и Msp I) и лигировали отдельные штрих-коды и общие адаптеры к расщепленной ДНК. .Мы объединили фрагменты со штрих-кодом от 192 человек, очистили и сконцентрировали библиотеки с помощью SeraMag Speed Beads собственного производства (Rohland and Reich 2012) и амплифицировали фрагменты с помощью 12 циклов ПЦР. Мы исчерпали высококопийные фрагменты на основе данных Todesco et al. (2019), используя следующие шаги: (1) денатурировать библиотеки с помощью высоких температур, (2) позволить фрагментам повторно гибридизоваться, (3) расщепить двухцепочечные фрагменты дуплекс-специфичной нуклеазой (Жулидов et al. 2004) и (4) амплифицировать непереваренные фрагменты с помощью еще 12 циклов ПЦР. Мы прогнали библиотеки на 1,5% агарозном геле и экстрагировали фрагменты размером 300-800 п.н. с помощью набора для восстановления ДНК Zymoclean Gel (Zymo Research, Ирвин, Калифорния). Затем, после дополнительной очистки библиотеки и оценки качества, мы секвенировали парные концы наших библиотек на Illumina HiSeq 2000 (Illumina Inc., Сан-Диего, Калифорния).
Для вызова вариантов мы использовали конвейер, который объединяет выравниватель Берроуза – Уиллера версии 0.7.15 (BWA) (Li and Durbin 2010) и инструментарий анализа генома версии 3.7 (GATK) (McKenna et al. 2010). Сначала мы демультиплексировали данные с помощью saber (Joshi 2011). Затем мы согласовали показания с эталоном H. annuus (HanXRQr1.0-20151230; Badouin et al. 2017) с BWA-mem (Li 2013), назвав варианты с GATK «HaplotypeCaller», и совместно генотипировали все образцы. внутри перекрестного типа с GATK «GentypeGVCFs». Мы разделили варианты на SNP и вставки / удаления (инделки) и отфильтровали каждый тип маркера с использованием критериев жесткой фильтрации, предложенных в лучших практиках GATK (DePristo et al. 2011; Van der Auwera et al. 2013). В частности, мы удалили SNP, которые имели качество по шкале глубины (QD) <2, оценки смещения цепочки (FS)> 60, среднее качество картирования (MQ) <40 или оценки смещения картирования аллелей (MQRankSum) <-12,5, а также индели, которые имели QD <2 или FS> 200. После дальнейшей фильтрации вариантов для двуаллельных и триаллельных маркеров с вызовами генотипа не менее чем у 50% людей мы использовали GATK «VariantsToTable» для объединения SNP и индексов в единую таблицу вариантов для каждого типа скрещивания.
Наконец, мы преобразовали наши таблицы вариантов в формат AB, так что гетерозиготные родители вносят аллели «A» и «B» в потомство, в то время как родитель H. annuus вносит исключительно аллели A. На двуаллельных маркерах (рис. 2А) сайты с двумя референсными аллелями стали «AA», а сайты с референсным аллелем и альтернативным аллелем стали «AB». На триаллельных маркерах (рис. 2B) сайты с эталонным аллелем и одним альтернативным аллелем стали AA, а сайты с эталонным аллелем и другим альтернативным аллелем стали «AB».Этот метод случайным образом назначает аллели A и B гомологичным хромосомам каждого гетерозиготного родителя, поэтому наши генетические карты изначально состояли из пар зеркально отображенных групп сцепления, которые мы позже объединили.
Генетическое картирование
Мы использовали R / qtl (Broman et al. 2003) вместе с R / ASMap (Taylor and Butler 2017) для построения генетических карт. После исключения маркеров с гетерозиготностью <20% или> 80% и лиц с набранными маркерами <50%, мы использовали функцию «mstmap.крест »со строгим порогом значимости ( P -значение = 1 × 10 -16 ) для формирования консервативных групп сцепления. Мы использовали функцию «plotRF» для идентификации пар групп сцепления с необычно высокими фракциями рекомбинации и функцию «switchAlleles» для изменения оценок генотипа одной группы сцепления в каждой зеркальной паре. Мы делали это до тех пор, пока изменение оценок генотипа больше не уменьшало количество групп сцепления.
Используя скорректированные генотипы, мы создали новые группы сцепления с использованием только самых надежных маркеров.А именно, мы использовали функцию «mstmap.cross» (со значениями параметров: dist. Fun = «kosambi», P -value = 1 × 10 −6 , noMap.size = 2 и noMap.dist = 5) на маркерах с отсутствующими данными <10% и без значительного искажения сегрегации. Мы уточнили полученные группы сцепления, удалив: (1) маркеры с более чем тремя двойными кроссоверами, (2) маркеры с аберрантными паттернами сегрегации (искажение сегрегации> 2 SD выше или ниже среднего искажения сегрегации ближайших 20 маркеров) и ( 3) группы сцепления, состоящие из менее чем четырех маркеров.
Мы постепенно добавляли маркеры на карты с увеличивающимся уровнем искажения сегрегации и отсутствующими данными с помощью функции «pushCross». После добавления каждой партии маркеров мы изменили порядок групп связей и удалили маркеры и группы связей, как описано выше. После того, как все маркеры были сдвинуты, мы использовали функцию «calc.errorlod» для выявления возможных ошибок генотипирования (оценка ошибок> 2) и заменили эти генотипы недостающими данными. Мы продолжали отбрасывать группы сцепления, маркеры и генотипы, которые не соответствовали нашим критериям, пока их не осталось.
Наконец, мы удалили пять лишних групп связей, каждая из которых состоит из <30 маркеров, с каждой карты. Маркеры в этих группах сцепления сопоставлены с областями генома H. annuus , которые иначе были представлены в окончательных генетических картах, но не могли быть объяснены обратными генотипами. Вместо этого эти маркеры, вероятно, были полиморфными у индивидуума HA89cms, использованного для скрещиваний, из-за остаточной гетерозиготности 2–4% у инбредных линий подсолнечника (Mandel et al. 2013).
Разработка syntR
Чтобы помочь в идентификации хромосомных перестроек, мы разработали пакет SyntR R (код и документация доступны на http://ksamuk.github.io/syntR). Этот пакет реализует эвристический алгоритм для систематического обнаружения блоков синтении по позициям маркеров на двух генетических картах. Ключевым нововведением алгоритма syntR является соединение биологически обоснованного метода уменьшения шума с методом идентификации кластеров, который лучше подходит для обнаружения линейных (в отличие от круговых) кластеров точек данных.
Мы основали алгоритм syntR на следующих статистических и биологических свойствах генетических карт и хромосомных перестроек:
Блоки Synteny появляются как смежные наборы ортологичных маркеров в том же или обратном порядке в парах генетических карт (Pevzner and Tesler 2003 ; Choi et al. 2007).
Предполагаемый порядок маркеров на индивидуальных генетических картах подвержен ошибкам из-за ошибок генотипирования и отсутствия данных (Hackett and Broadfoot 2003).Эта ошибка проявляется в небольших различиях в порядке расположения ближайших маркеров в группе привязки между картами. Эта ошибка отображения (которую мы обозначаем «коэффициент ошибок один») приводит к неопределенности в последовательности маркеров в блоках синтении.
В геномах с историей дупликации кажущиеся ортологическими маркеры действительно могут представлять паралоги. Эти ошибки («коэффициент ошибок два») выглядят как крошечные транслокации и также нарушают порядок маркеров в блоках синтении.
При сравнении генетических карт, полученных из геномов без дупликаций или делеций, каждая область каждого генома будет уникально представлена в другом.Поскольку syntR создан для сравнения гомоплоидных геномов с этим свойством, мы ожидаем, что каждая точка на каждой генетической карте будет содержаться в одном уникальном блоке синтении. Следовательно, перекрытия между блоками синтении являются вероятными ошибками. Обратите внимание, что это предположение исключает выявление дубликатов.
Хромосомные перестройки могут быть любого размера, но меньшие перестройки трудно отличить от ошибки (Pevzner and Tesler 2003). Таким образом, ключевым решением при обнаружении блока синтении является выбор порога обнаружения для небольших перегруппировок, что приводит к компромиссу между уменьшением ошибок и минимальным размером обнаруживаемых блоков синтении.
Первым шагом алгоритма syntR является сглаживание ошибки отображения (коэффициент ошибок один) путем определения высоколокализованных кластеров маркеров на основе порога генетического расстояния (cM) на обеих картах с использованием иерархической кластеризации (рисунок 3A). Количество сформированных кластеров определяется параметром максимального диапазона кластеров (CR max ), который определяет максимальное генетическое расстояние (cM), которое любой кластер может охватывать на любой генетической карте. После определения этих начальных кластеров мы сглаживаем карты, свертывая каждый многомаркерный кластер в единую репрезентативную точку (центроид кластера) для обработки на последующих этапах.Затем мы устраняем ошибки, вызванные плохо сопоставленными или паралогичными маркерами (частота ошибок два), отмечая и удаляя кластеры выбросов, у которых нет соседнего кластера в пределах указанного максимального генетического расстояния (cM), параметра, который мы обозначаем расстояние до ближайшего соседа (NN dist , рис. 3В).
Рисунок 3
Этапы алгоритма SyntR. Каждый график показывает взаимосвязь между маркерами или кластерами маркеров из трех хромосом на двух генетических картах. (A) Сильно локализованные маркеры сгруппированы.Каждый оттенок представляет собой отдельный кластер маркеров, который будет свернут в одну репрезентативную точку. (B) Кластеры без соседних кластеров отбрасываются. Красные точки представляют собой кластеры без соседей в пределах 10 см. (C) Кластеры сгруппированы в блоки синтении на основе их ранговых позиций. Серые точки представляют собой маркеры, которые были отброшены на предыдущих шагах, а каждый другой цвет представляет другой блок синтении.
После шагов по уменьшению шума мы определяем предварительные блоки синтении, используя метод, аналогичный алгоритму кластеризации «друзей друзей» (Huchra and Geller 1982).Во-первых, мы преобразуем генетическое положение каждого кластера в порядок ранжирования, чтобы минимизировать влияние пробелов между маркерами. Затем мы группируем кластеры, которые: (1) соседствуют по позиции ранга на одной из карт и (2) находятся в пределах двух позиций ранга на другой карте (Рисунок S2). Этот метод группирования дополнительно снижает влияние ошибки сопоставления за счет агрегирования по парам (но не по тройкам) кластеров с обратной ориентацией. Если минимальное количество кластеров на блок synteny было определено (необязательно), мы последовательно удаляем блоки, которые попадают ниже минимального количества кластеров, начиная с блоков, составленных из одного кластера, и заканчивая блоками, составленными из кластеров, равных на единицу меньше, чем минимум.После каждого исключения мы перегруппируем кластеры в новые блоки синтении. Наконец, мы корректируем размеры каждого блока синтении, удаляя перекрывающиеся секции из обоих блоков синтении, чтобы каждая позиция в каждой генетической карте была уникально представлена (рис. 3C).
Оценка производительности алгоритма syntR
Чтобы оценить производительность этого метода и изучить влияние выбора параметра на результаты, мы смоделировали сравнение генетических карт с известными точками останова инверсии и частотой ошибок в R.Сравнение генетических карт производилось путем случайного размещения 200 маркеров в 100 положениях вдоль 100-сМ хромосомы на двух картах, изменения положения маркеров в пределах определенной области инверсии на одной карте, а затем изменения положения маркеров на основе имитированного шума картирования с использованием следующих двух ошибок. параметры: (1) ER 1 — SD нормального распределения, используемого для выбора расстояний, маркеры выталкиваются из своих правильных положений ( например, , когда ER 1 составляет 1 см, 95% маркеров будут в пределах 2 см от их истинного положения) и (2) ER 2 — это доля маркеров, которые перемещаются в соответствии с равномерным распределением ( i.е. , эти маркеры можно переместить в любую позицию на моделируемой хромосоме).
Первоначально мы запускали syntR с использованием фиксированных параметров syntR (CR max = 2 и NN dist = 10) на нескольких смоделированных картах, которые были созданы с использованием переменных параметров (размер инверсии: 2,5–50 см, ER 1 : 0–2,0 см и ER 2 : 0–20%) и подсчитали, сколько раз известные контрольные точки были идентифицированы в пределах 1 см (Рисунок S3). Как и ожидалось, мы обнаружили, что размер перегруппировки влияет на частоту ложноотрицательных результатов ( i.е. , не в состоянии обнаружить известные точки останова), так что меньшие инверсии с большей вероятностью будут пропущены (рисунок S3C), но не влияет на частоту ложных срабатываний (, т.е. , обнаружение точек останова там, где их нет). Мы также обнаружили, что увеличение обоих типов ошибок в генетических картах имеет тенденцию к увеличению как ложноположительных, так и ложноотрицательных показателей, хотя ER 1 оказывает гораздо более сильное влияние на частоту ложноположительных результатов, чем любая другая комбинация (Рисунок S3 , А и Б).
Используя те же методы моделирования, что и выше, но теперь изменяя параметр syntR CR max , мы обнаруживаем, что небольшие значения CR max дают высокий процент ложноположительных результатов, тогда как большие значения дают высокий уровень ложноотрицательных результатов (рисунок S4A).Кроме того, параметр ER 1 оказывает сильное влияние на взаимосвязь между CR max и частотой ложных срабатываний. Более высокие значения CR max необходимы, чтобы снизить частоту ложных срабатываний, когда ER 1 также высокий (рисунок S4B). Это означает, что выбор подходящего значения CR max является ключом к точности этого метода. Хотя NN dist оказывает гораздо более слабое влияние на результаты, чем CR max , полезно внимательно рассмотреть значения обоих параметров.
Когда эвристический алгоритм syntR работает хорошо, заключительные блоки синтении должны представлять все позиции в двух сравниваемых генетических картах (Chen et al. 2009). Основываясь на этой характеристике, мы разработали метод выбора оптимальных параметров настройки синтезатора (CR max и NN dist ), которые максимизируют представление генетических карт и маркеров в блоках синтении. В этом методе пользователь: (1) запускает syntR с диапазоном комбинаций параметров, (2) сохраняет сводную статистику о генетическом расстоянии каждой карты, представленной в блоках synteny, и количестве маркеров, сохраняемых для каждого запуска, и (3) находит комбинацию параметров, которая максимизирует составную статистику, которая одинаково взвешивает эти три показателя.В случаях, когда имеется несколько локальных максимумов, мы предлагаем выбрать локальный максимум с наименьшим значением CR max , чтобы уменьшить количество потенциальных ложных срабатываний.
Метод «максимального представления» для выбора параметров syntR имеет несколько преимуществ. Во-первых, он не полагается на какую-либо дополнительную информацию (, например, , оценки частоты ошибок из сравниваемых генетических карт). Во-вторых, когда мы используем этот метод для выбора наилучших параметров для смоделированных генетических карт, мы обнаруживаем, что значения этих параметров также минимизируют количество ложноположительных и ложноотрицательных результатов (рисунок S5).В-третьих, когда мы моделируем биологически реалистичные сравнения генетических карт, абсолютные значения ложноположительных и ложноотрицательных результатов невелики. Например, при сравнении двух генетических карт, на которых ~ 95% маркеров находятся в пределах 1 см от их истинного положения (ER 1 = 0,5), а 5% маркеров переставлены случайным образом (ER 2 = 0,05), несуществующие контрольные точки будет идентифицироваться 0,1 раза, а точка останова инверсии 20 см будет пропущена 0,04 раза. Такой низкий уровень ошибок также подчеркивает общую надежность и точность алгоритма SyntR.
В дополнение к выполнению моделирования мы сравнили блоки синтении, идентифицированные с помощью syntR, с блоками, идентифицированными другими способами в ранее опубликованном сравнении H. niveus ssp. тефроды и H. argophyllus сопоставляются с H. annuus (Barb et al. 2014). Для этого мы отформатировали исходные наборы данных для ввода в syntR и использовали метод «максимального представления», чтобы определить оптимальные значения параметров для двух сравнений ( H.niveus по сравнению с H. annuus : CR max = 1,5, NN dist = 30; H. argophyllus vs.H. Annuus : CR max = 2, NN dist = 20). Мы обнаружили, что syntR полностью согласуется с предыдущей работой (рис. S6), восстанавливая все те же транслокации и большинство тех же инверсий, что и Barb et al. (2014) карты. В большинстве случаев несовпадения были очень маленькими или слабо поддерживаемыми инверсиями в Barb et al. (2014) карты, которые не удалось идентифицировать SyntR.
Поиск блоков синтении
Мы использовали syntR для идентификации блоков синтении между нашими недавно созданными генетическими картами и картой сверхвысокой плотности H. annuus , которая использовалась для построения генома подсолнечника, который мы использовали в качестве эталона (Badouin et al. al. 2017). Это позволило нам легко преобразовать физическое положение в эталоне H. annuus и положение на генетической карте H. annuus . Используя это свойство, мы далее сравнили две ранее опубликованные генетические карты близкородственного вида подсолнечника H.niveus ssp. tephrodes и H. argophyllus (Barb et al. 2014) на той же карте H. annuus . Мы выровняли последовательности маркеров из опубликованных карт с эталоном H. annuus с использованием BWA и преобразовали хорошо выровненные маркеры (MQ> 40) в их положения на генетической карте H. annuus .
Первоначально мы запускали syntR, используя параметры, определенные с помощью метода «максимального представления» для каждого сравнения карт отдельно (Таблица S1).Однако изменение CR max выявило перестройки, которые были общими для карт (рисунок S7). Поэтому мы снова запустили syntR, используя диапазон значений CR max , которые включали наилучшее соответствие для каждого сравнения (1,0–3,5 с шагом 0,5), и извлекли тщательно подобранный набор блоков synteny из выходных данных. Блок синтении сохранялся, если он удовлетворял любому из следующих критериев (в порядке убывания важности): (1) он был обнаружен у другого вида, (2) он был идентифицирован в большинстве прогонов syntR для одного вида и ( 3) он максимизировал генетическое расстояние, представленное блоками синтении.Мы представляем этот тщательно подобранный набор блоков синтении ниже, но наши результаты не изменятся, если мы будем использовать индивидуально подобранные блоки синтении.
Мы назвали хромосомы на наших генетических картах на основе их синтении со стандартным порядком и ориентацией хромосом H. annuus (Tang et al. 2002; Bowers et al. 2012) после Barb et al. (2014), но с укороченными префиксами (A = H. annuus , R = H. argophyllus , N = H.niveus ssp. тефроды , P = H. petiolaris ssp. petiolaris и F = H. petiolaris ssp. fallax ). Например, H. petiolaris ssp. Хромосома fallax , состоящая из областей, которые синтеничны с хромосомами 4 и 7 H. annuus , называется F4-7.
Реконструкция и анализ кариотипа
Мы использовали наши выведенные блоки синтении и программу MGR v 2.01 (Bourque and Pevzner 2002), чтобы вывести наследственные кариотипы для наших пяти таксонов Helianthus и определить количество хромосомных перестроек, произошедших вдоль каждой ветви. дерева видов.Для проведения анализа MGR нам потребовались порядок и ориентация блоков синтении на всех пяти картах. Однако отдельные блоки синтении часто отсутствовали на одной или нескольких наших финальных картах. Мы подошли к этой проблеме двояко. Во-первых, мы сделали вывод о вероятном положении отсутствующих блоков синтении на основе расположения маркеров, которые были слишком редкими для группировки с помощью syntR, и сопоставили расположение блоков синтении на других картах. Во втором случае мы отбросили все блоки синтении, которые не были представлены повсеместно.Поскольку у нас уже было два набора блоков синтении для каждой карты (отобранные и индивидуально оптимизированные), мы выполнили анализ MGR с использованием трех разных наборов блоков синтении: набор 1 (отобранный и предполагаемый), набор 2 (отобранный и присутствующий на всех пяти картах). ) и набор 3 (индивидуально оптимизирован и присутствует на всех пяти картах).
Результаты
Генетические карты
Обе генетические карты H. petiolaris состоят из 17 ожидаемых хромосом и имеют очень высокие плотности маркеров (Рисунок 4 и Рисунок S8).Только 6% из H. petiolaris ssp. petiolaris и 10% от H. petiolaris ssp. На карте fallax нет маркера в пределах 2 см (Рисунок S9). В целом обе карты несколько длиннее, чем карта H. petiolaris , описанная Burke et al. (2004). Хотя это может представлять реальную вариацию между генотипами, это также может быть результатом ложных кроссоверов, которые предполагаются на основе ошибок генотипирования. Поскольку ошибки генотипирования пропорциональны количеству маркеров, карты с высокой плотностью маркеров с большей вероятностью будут раздуты.Действительно, построение карт с вариантами, уменьшенными до 1 на 150 пар оснований с использованием vcftools версии 0.1.13 (Danecek et al. 2011), дает коллинеарные карты, которые ближе к ожидаемой длине (Рисунок S10 и Таблица S2). Мы представляем последующие результаты, основанные на полных картах, чтобы улучшить наше разрешение для обнаружения небольших перестроек.
Рисунок 4 Генетические карты
H. petiolaris , показывающие блоки синтении с H. annuus . Каждая горизонтальная полоса представляет собой генетический маркер.Толстые вертикальные полосы рядом с хромосомами представляют блоки синтении, инвертированные относительно генетической карты H. annuus . Если нет транслокаций между хромосомами H. petiolaris и H. annuus (, например, , все блоки синтении в P1 и F1 синтеничны с A1), блоки синтении показаны серым. Там, где есть транслокации, блоки синтении имеют цветовую кодировку в зависимости от их синтении с хромосомами H. annuus . Области, не назначенные блоку синтении, остаются белыми.На графике показаны блоки синтении, созданные на основе нескольких запусков syntR с разными параметрами. См. Рисунок S12 для обозначенной версии. Этот рисунок был сделан с помощью LinkageMapView (Ouellette et al. 2017).
Несмотря на общее расширение наших карт, мы обнаруживаем, что хромосомы 2 и 4 в H. petiolaris ssp. fallax Карты (F2 и F4) неожиданно короткие (Рисунок 4). Когда мы смотрим на распределение маркеров на этой карте относительно H.annuus , мы находим очень мало вариабельных сайтов в дистальной половине этих хромосом (Рисунок S11). То есть этот человек был гомозиготным по обширным участкам F2 и F4. Эти серии гомозиготности можно объяснить недавним общим происхождением (, т.е. , инбридинг) или отсутствием вариаций в популяции (, например, , из-за фонового отбора или недавнего отбора). Несмотря на это, отсутствие вариабельных сайтов в пределах H. petiolaris ssp. fallax , используемый для крестов, объясняет краткость F2 и F4.Примечательно, что мы находим тот же образец на дистальной половине хромосомы 7 H. annuus и обнаруживаем, что эта область также не представлена в H. petiolaris spp. fallax карта.
Блоки Synteny
Используя syntR, мы восстановили 97 генетических областей, которые являются синтеническими между H. petiolaris ssp. petiolaris и H. annuus и 79 генетических областей, которые являются синтеничными между H. petiolaris ssp. fallax и H.annuus (рисунок 4). Мы также восстановили блоки синтении для H. niveus ssp. tephrodes и H. argophyllus сравнения, которые аналогичны найденным ранее (Рисунок S13). Во всех четырех сравнениях syntR успешно идентифицировала блоки синтении, которые покрывают большие доли (63–90%) каждой генетической карты, даже несмотря на очень высокую долю маркеров, которые отображаются на хромосомы, отличные от их соседей (Table 1). Эти «ложные маркеры» могут быть результатом очень маленьких транслокаций, плохо картированных маркеров или обширной паралогии.Помимо распространенности ложных маркеров, восстановленные нами кариотипы существенно перестроены. Только от 32% до 45% блоков синтении для каждой карты коллинеарны генетической карте H. annuus при прямом сравнении (Таблица 1).
Таблица 1 Свойства блоков синтении, найденные с помощью анализа syntR между генетическими картами H. annuus и четырех других таксонов Helianthus
Реконструкция кариотипа и хромосомная перестройка
Поскольку вложенные и общие перестройки могут скрывать закономерности эволюции хромосом, мы используйте анализ MGR, чтобы предсказать наиболее вероятную последовательность перегруппировок в филогенетическом контексте перед количественной оценкой скорости реаранжировки.Эти анализы MGR выявили сходные паттерны эволюции хромосом независимо от точного набора блоков синтении, которые мы использовали (Таблица S5). Множественные таксоны имеют много общих перестроек, и сходство кариотипов соответствует известным филогенетическим отношениям. Более того, анализы MGR, выполняемые без направляющего дерева, выводили известное дерево видов, а анализы MGR, выполняемые со всеми другими топологиями, выявляли завышенное количество хромосомных перестроек.
Используя наиболее полный набор блоков синтении (набор 1), мы обнаруживаем, что 88 хромосомных перестроек произошло через филогении (Рисунок 5).Затем, используя самые последние оценки времени расхождения для этой группы (Todesco et al. 2019) и консервативно предполагая, что H. niveus ssp. тефродов разошлись в самой ранней возможной точке, по нашим оценкам, 7.9 (7.8–8) перегруппировок происходило за миллион лет в этой кладе (Таблицы S3 – S5). Чтобы дополнительно изучить потенциальный диапазон скоростей перегруппировки, мы рассмотрели другие оценки времени расхождения у подсолнечника (Sambatti et al. 2012; Mason 2018) и других наборов блоков синтении.В целом, самая низкая скорость, которую мы определили, составила 2,6 перегруппировки на миллион лет, в то время как самая высокая скорость была неопределенной, потому что некоторые оценки минимального времени расхождения для группы включают 0 (Таблицы S3 – S5).
Рисунок 5
Диаграмма, показывающая кариотипы пяти таксонов Helianthus , а также реконструированные наследственные кариотипы и расположение хромосомных перестроек. Кариотипы были построены с использованием набора блоков синтении 1 и были отобраны на основе нескольких запусков syntR и выводились в случае отсутствия.Каждый блок синтении представлен линейным сегментом, который имеет цветовую кодировку в зависимости от его положения в геноме H. annuus (см. Рисунок S14 для помеченной версии). Хромосомы без транслокаций на любой карте показаны серым цветом, а блоки синтении, инвертированные относительно H. annuus , нанесены с помощью стрелок. Также обратите внимание, что вдоль некоторых ветвей одна и та же пара хромосом участвует во множественных транслокациях.
88 перестроек включают 74 инверсии и 14 транслокаций, которые довольно равномерно распределены по филогении.Однако избыточные инверсии указывают на то, что маловероятно, что скорость инверсий равна скорости транслокации (биномиальный тест, 5,1 × 10 -11 ). Более того, мы обнаружили, что только 8 из 17 хромосом вовлечены в 14 идентифицированных нами транслокаций. Если бы транслокации были одинаково вероятны для всех хромосом, эта асимметрия была бы очень маловероятной (вероятность выборки не более восьми хромосом в 14 транслокациях составляет 8,0 × 10 -8 , рисунок S15), что позволяет предположить, что некоторые хромосомы являются более вероятно, что они будут участвовать в транслокациях, чем другие.В соответствии с этим наблюдением мы видим, что некоторые сегменты хромосом повторно перемещаются. Например, A4 и A7 участвуют в нескольких обменах, а часть A6 занимает разное положение почти на каждой карте (рис. 5).
Обсуждение
Крупномасштабные хромосомные изменения могут быть ключевыми факторами процесса адаптации и видообразования, но мы все еще плохо понимаем темпы хромосомных перестроек и эволюционные силы, лежащие в основе этих темпов. Здесь мы разработали новый систематический метод сравнения любых пар генетических карт и провели всесторонний анализ эволюции хромосомных перестроек в кладе подсолнухов.Мы создали две новые генетические карты для видов Helianthus и использовали наш новый метод для определения широкого диапазона кариотипических вариаций на наших новых картах, а также на ранее опубликованных картах. В соответствии с предыдущими исследованиями мы обнаружили высокую скорость хромосомной эволюции однолетних подсолнечников. Кроме того, мы обнаружили, что инверсии более распространены, чем транслокации, и что некоторые хромосомы с большей вероятностью будут перемещены. Ниже мы обсуждаем эволюционные и методологические последствия этой работы и предлагаем некоторые следующие шаги в понимании динамического процесса хромосомной перестройки.
Выявление перестроек
Изучение эволюции хромосомных перестроек требует плотных генетических карт и систематических методов для анализа и сравнения этих карт между видами. Наше новое программное обеспечение syntR представляет собой комплексное решение для систематической и повторяемой идентификации блоков синтении в парах генетических карт с любой плотностью маркеров. Наши тесты на реальных и смоделированных данных показывают, что syntR восстанавливает хромосомные перестройки, идентифицированные ранее как ручными сравнениями, так и цитологическими исследованиями, предполагая, что syntR обеспечивает точное представление о кариотипических различиях между видами.
В целом, мы считаем, что syntR будет ценным инструментом для систематического изучения хромосомных перестроек у любого вида. Единственное, что нужно SyntR данных для идентификации блоков синтении, — это относительные положения маркеров на двух генетических картах. Этот факт важен, потому что, хотя количество видов с полногеномными последовательностями и методами обнаружения блоков синтении из этих последовательностей быстро накапливается, например, Mauve (Darling et al. 2004), Cinteny (Sinha and Meller 2007), syMAP (Soderlund et al. 2011), SynChro (Drillon et al. 2014) и SyRI (Goel et al. 2019), по-прежнему редко бывает несколько тесно связанных полногеномных последовательностей, качество которых достаточно для сравнения на предмет различий в кариотипах. . В то же время распространение методов секвенирования генома с уменьшенным представлением означает, что легко создать множество генетических маркеров для немодельных видов и создать очень плотные генетические карты. Кроме того, syntR позволяет при сравнении включать более старые данные генетической карты, которые в противном случае остались бы неиспользованными.Простота алгоритма syntR облегчит быстрое картирование кариотипа в широком диапазоне таксонов.
Мы также считаем, что syntR обеспечивает основу для развития дальнейших вычислительных и статистических методов исследования хромосомных перестроек. Одним из плодотворных направлений может стать интеграция алгоритма syntR для обнаружения блоков синтении непосредственно в процесс построения генетической карты (во многом как в GOOGA; Flagel et al. 2019). Еще одно ключевое расширение — позволить syntR одновременно сравнивать несколько генетических карт для обнаружения блоков синтении в группе видов ( e.грамм. , используя информацию по видам). Наконец, формальные статистические методы для оценки соответствия модели и неопределенности, связанной с любым набором блоков синтении, были бы значительным (хотя и сложным) улучшением всех существующих методов, включая syntR.
Сходство карт
H. petiolaris с предыдущими исследованиями
По сравнению с предыдущей работой, мы обнаружили больше инверсий и меньше транслокаций между подвидами H. petiolaris и H.annuus (Rieseberg et al. 1995; Burke et al. 2004). Вероятно, это связано с рядом факторов. Во-первых, у некоторых видов Helianthus есть кариотипические вариации (Heiser 1948, 1961; Chandler et al. 1986). Во-вторых, представленные здесь карты состоят из большего количества маркеров и индивидов, что позволило нам идентифицировать небольшие инверсии, которые ранее не были обнаружены, а также устранить ложные связи, которые могут быть проблематичными в небольших популяциях карт.Наконец, нам потребовалось больше доказательств, чтобы вызвать перестановки. Хотя мы восстановили некоторые транслокации, поддерживаемые множеством маркеров, в Rieseberg et al. (1995) и Burke et al. (2004), мы не обнаружили никаких транслокаций, поддерживаемых только одним маркером на основе последовательности. Учитывая высокую долю ложных маркеров на наших картах, вполне вероятно, что некоторые из предполагаемых транслокаций, восстановленных в тех более ранних сравнениях, являются результатом того же явления.
С другой стороны, мы обнаружили, что перестановки между нашим H.petiolaris довольно хорошо совпадают с транслокациями, предсказанными цитологическими исследованиями. Heiser (1961) предсказал, что H. petiolaris ssp. petiolaris и H. petiolaris ssp. fallax Кариотип должен иметь три хромосомы, участвующие в двух транслокациях, которые образуют кольцо во время спаривания в мейозе, а также возможность второй независимой перестройки. Эта точная конфигурация, вероятно, встречается в мейозе у гибридов между H.petiolaris карты подвидов, которые мы представляем здесь (Рисунок S16). Кроме того, наиболее примечательная конфигурация хромосом в цитологических исследованиях H. annuus – H. petiolaris (Heiser 1947; Whelan 1979; Ferriera 1980; Chandler et al. 1986) был шестивалентным (шестихромосомная структура) плюс четырехвалентный (четыреххромосомная структура). Опять же, это конфигурация, которую мы ожидаем от гибрида между H. annuus и H. petiolaris ssp. petiolaris особь, нанесенная на карту здесь. Более того, сложное расположение и относительно небольшие размеры блоков синтении A12, A16 и A17 в H. petiolaris могут объяснить, почему цитологические конфигурации у H. annuus-H. petiolaris настолько разнообразны. Интересно, что перестройки, идентифицированные между кариотипами H. argophyllus и H. annuus здесь и в Barb et al. (2014) также соответствует цитологическим исследованиям лучше, чем предыдущее сравнение разреженных генетических карт (Heesacker et al. 2009). Похоже, что в системах с потенциалом высокой доли ложных маркеров необходимо много маркеров для надежной идентификации хромосомных перестроек.
Общие темпы перестройки
Наши данные показывают, что ежегодные хромосомные перестройки подсолнечника составляют около 7,9 за миллион лет. Этот показатель совпадает с недавними оценками для этой группы (7.4-10.3, Barb et al. 2014) и даже выше, чем оценка, которая выделила подсолнечник как группу с исключительно быстрой хромосомной эволюцией (5.5–7.3, Burke et al. 2004). Однако, поскольку Burke et al. (2004), хромосомные перестройки отслеживались во многих дополнительных группах, включая млекопитающих (Ferguson-Smith and Trifonov 2007; Martinez et al. 2016; Oliveira da Silva et al. 2019), рыб (Molina et al. 2014; Ayres-Alves et al. 2017), насекомых (Rueppell et al. 2016; Corbett-Detig et al. 2019), грибов (Sun et al. 2017) и растений ( Йогесваран и др. 2005; Schranz et al. 2006; Хуанг и др. 2009; Международная инициатива по брахиподиуму 2010; Latta et al. 2019). Из этих анализов относительно немногие систематически изучали эволюцию кариотипа у нескольких видов и оценивали общие скорости реорганизации. Большинство исследований сообщают о <7,9 хромосомных перестройках на миллион лет, например, в Solanum (0,36–1,44; Wu and Tanksley 2010), Drosophila (0,44–2.74; Bhutkar et al. 2008) и млекопитающих (0,05–2,76; Murphy et al. 2005). Однако есть исключения, такие как сравнение последовательностей генома, которое выявило до 35,7 перестроек на миллион лет в некоторых линиях трав (Dvorak et al. 2018).
В то же время, мы, вероятно, недооцениваем скорость реорганизации здесь по двум причинам. Во-первых, мы использовали консервативные пороги для вызова перегруппировок. Например, некоторая часть выявленных нами маркеров-мошенников могла быть результатом очень небольших, но настоящих хромосомных перестроек.Во-вторых, наша способность разрешать очень маленькие блоки синтении и точки останова между блоками синтении зависит от плотности маркеров. Пока у нас не будет полных последовательностей генома для сравнения (например, для линий травяного происхождения), мы можем не обнаруживать очень маленькие реаранжировки и ложно предполагать, что независимые реаранжировки являются общими. Однако, независимо от того, насколько мы недооцениваем скорость, хромосомы подсолнечника быстро развиваются. Такая высокая скорость хромосомной эволюции может быть следствием более высокой скорости хромосомных мутаций, снижения вероятности утраты хромосомных полиморфизмов или обоих процессов.
Тип перестройки
Мы обнаружили, что инверсии и межхромосомные транслокации доминируют в хромосомной эволюции у Helianthus . Этот образец характерен для линий покрытосеменных (Weiss-Schneeweiss and Schneeweiss 2012) и согласуется с постоянным количеством хромосом у однолетних подсолнечников (2 n = 34; Chandler et al. 1986). Кроме того, мы обнаружили больше инверсий, чем транслокаций, что ранее наблюдалось у обоих растений (Wu and Tanksley 2010; Amores et al. 2014) и животных систем (Rueppell et al. 2016) и перекликается с общими сообщениями о том, что внутрихромосомные перестройки более распространены, чем межхромосомные перестройки (Pevzner and Tesler 2003). Эти постоянные различия в скорости заметны, потому что, хотя оба типа реаранжировки зависят от двухцепочечных разрывов, два основных следствия хромосомных перестроек, недостаточное доминирование (, т.е. , гетерозиготы реаранжировки менее подходят, чем любая гомозигота) и рекомбинационная модификация, могут быть более значительными. общий для некоторых типов перестановок.
Транслокации более предсказуемо влияют на фертильность гибридов, в то время как инверсии последовательно снижают рекомбинацию. Гетерозиготы с реципрокной транслокацией могут влиять на фертильность, потому что неправильная сегрегация во время мейоза может привести к тому, что половина гамет будет неуравновешенной и, следовательно, неактивной (White 1973; King 1993). Хотя инверсионные гетерозиготы также могут продуцировать несбалансированные гаметы, происходит ли это, зависит от размера инверсии и подавляет ли нарушенное спаривание во время мейоза кроссоверы (Searle 1993).Когда инверсии малы или имеют подавленный кроссинговер, они не будут сильно подчиняться. С другой стороны, инверсии часто демонстрируют сниженную рекомбинацию либо потому, что рекомбинация подавляется из-за нарушенного спаривания (Searle, 1993), либо неэффективна из-за образования неактивных гамет (Rieseberg 2001). Хотя взаимодействие между сниженной рекомбинацией и адаптацией с потоком генов было тщательно изучено в случае инверсий (Киркпатрик и Бартон, 2006; Хоффманн и Ризеберг, 2008; Йеман и Уитлок, 2011; Йеман, 2013), неясно, будет ли такая же закономерность распространена. для транслокаций [но см. Fishman et al. (2013) и Stathos and Fishman (2014) для одного примера]. Транслокации объединяют ранее несвязанные аллели, и неправильное спаривание в точках остановки транслокации может подавлять кроссинговер, но рекомбинация внутри реципрокных транслокаций не обязательно приводит к образованию незаметных гамет и, таким образом, снижает эффективную рекомбинацию.
Хотя любая селективная сила может быть ответственна за эволюцию любой хромосомной перестройки, потенциальные различия в относительной величине недостаточного доминирования vs.Подавление рекомбинации может способствовать эволюции хромосом подсолнечника. В то время как многие хромосомные перестройки у подсолнечника, по-видимому, сильно не доминируют (Chandler et al. 1986, Lai et al. 2005), инверсии, как правило, не являются (L. Rieseberg, неопубликованные данные). Если транслокации имеют тенденцию быть менее доминирующими, чем инверсии, они с меньшей вероятностью будут развиваться посредством дрейфа и с большей вероятностью напрямую вызовут репродуктивную изоляцию. Это могло бы объяснить, почему транслокации менее распространены, чем инверсии, и почему жизнеспособность пыльцы точно предсказывается количеством транслокаций, выведенных из цитологических исследований (Chandler et al. 1986). В то же время недавний геномный анализ выявил несколько обширных областей с очень низкой рекомбинацией, вызванной большими инверсиями, сегрегационными в естественных популяциях подсолнечника (Todesco et al. 2019; Huang et al. 2019). Мутации, которые сегрегируют на длительные периоды, вряд ли будут сильно недодоминантными, и эти инверсии связаны с множественными адаптивными аллелями (Todesco et al. 2019), что согласуется с ролью отбора в их происхождении или поддержании.
Неслучайная хромосомная перестройка
Мы также обнаружили, что некоторые хромосомы подсолнечника участвуют в большем количестве транслокаций, чем другие. Эта закономерность наблюдалась у пшеницы (Бадаева и др. 2007), и повторное использование точки разрыва является обычным явлением в сравнительных исследованиях кариотипов (Певзнер и Теслер 2003; Бейли и др. 2004; Мерфи и др. 2005; Ларкин и др. 2009). Многие исследования подтверждают идею о том, что хромосомные области с большим сходством последовательностей с большей вероятностью будут рекомбинировать и, таким образом, потенциально создавать новые хромосомные структуры.Некоторые из наиболее ярких примеров этого можно найти в литературе по полиплоидии, в которой хромосомы с наследственной гомологией с большей вероятностью будут рекомбинировать (Николас и др. 2007; Мароне и др. 2012; Мейсон и др. 2014; Теннессен ). и др. 2014; Нгуепджоп и др. 2016 г.). Однако центромеры и другие повторяющиеся области также могут влиять на скорость мутаций, вызывающих хромосомные перестройки (Hardison et al. 2003; Murphy et al. 2005; Раскина и др. 2008; Molnár et al. 2010; Vitte et al. 2014; Ayers-Alves et al. 2017; Ли и др. 2017; Corbett-Detig et al. 2019). Учитывая, что у подсолнечника есть несколько дупликаций генома и всплеск активности мобильных элементов в их эволюционной истории (Barker et al. 2008, 2016; Kawakami et al. 2011; Staton et al. 2012; Badouin et al. 2017), вполне вероятно, что предковая гомология или содержание повторов могут быть связаны со склонностью к транслокации.
Из вышеперечисленных возможностей ассоциация между повторяющимися транслокациями и центромерами была бы особенно убедительной. Помимо содержания повторов центромер, объясняющих неслучайную мутацию [Kawabe et al. (2006) и Sun et al. (2017), но см. Lin et al. (2018) и Okita et al. (2019)], известно, что положение и размеры центромер на хромосомах влияют на мейотический драйв, и, таким образом, изменение положения центромер посредством перестройки может вызывать неслучайную фиксацию транслокаций (Kaszás and Birchler 1998, Chmátal et al. 2014; Zanders et al. 2014). Относительное расположение центромер было связано с эволюцией хромосом у Brassica (Schranz et al. 2006) и пшеницы (Badaeva et al. 2007), а ассоциации между мейотическим драйвом и эволюцией хромосом были обнаружены у нескольких животных. таксоны (Бидау и Марти 2004; Палестис и др. 2004; Молина и др. 2014; Блэкмон и др. 2019). У подсолнечника мы видим некоторые намеки на то, что центромерные повторы могут быть связаны с повторяющейся транслокацией.Используя расположение центромер-специфической ретротранспозонной последовательности HaCEN-LINE (Nagaki et al. 2015), чтобы приблизительно определить расположение центромер в нашей ссылке, мы обнаруживаем, что некоторые контрольные точки реаранжировки, например, , участок A16 с различным положением на каждой карте, близок к предполагаемым центромерам (Рисунок S17 – S20). Хотя для того, чтобы сделать твердые выводы о важности центромер для хромосомной эволюции подсолнечника, необходим более тщательный анализ местоположений центромерных повторов и их связи с точками разрыва реаранжировки, в настоящее время ведется разработка эталонных последовательностей для видов дикого подсолнечника, которые позволят и те, и другие. ассоциации подлежат подтверждению.Далее, пришло время непосредственно проверить мейотический драйв в этой системе, исследуя передачу перестроек, которые затрагивают центромеры в гаметах, продуцируемых растениями, которые имеют гетерозиготные кариотипы.
Заключение
Понимание эволюции хромосомных перестроек остается ключевой задачей эволюционной генетики. Разрабатывая новое программное обеспечение для систематического обнаружения блоков синтении и строя новые генетические карты, мы показываем, что подсолнухи демонстрируют быстрые и неслучайные паттерны хромосомной эволюции.Эти данные генерируют конкретные и проверяемые гипотезы об эволюции хромосом подсолнечника. Мы считаем, что наша работа подтолкнет к дополнительным исследованиям кариотипической эволюции и разнообразия и в конечном итоге приведет к более полному пониманию взаимодействия между хромосомной эволюцией и видообразованием.
Биологический проект http://www.biology.arizona.edu КРЕДИТЫ |
Геномные ресурсы кошек — кариотипы
Для домашней кошки было разработано множество генетических и геномных ресурсов.Каждый ресурс добавил к знаниям о геноме кошки, помогая исследователям в разработке домашней кошки как модели человеческого заболевания, улучшая здоровье самой кошки, а также помогая судебно-медицинским приложениям. Все соответствующие ресурсы могут быть перечислены на этом веб-сайте — пожалуйста, отправляйте дополнительные ресурсы, которые являются новыми или могли быть упущены из виду.
Хромосомный комплект домашней кошки составляет 2N = 38 (N = 19) с 18 аутосомами и половыми хромосомами XY (XX — самка, XY — самец).Различные цитогенетические методы, такие как R-, RBG-бэндинг и исследования хрупких участков, также помогли различить и охарактеризовать кошачьи хромосомы. 47-49,52 Например, у кошек нет значительного хрупкого Х-сайта на Х-хромосоме, который обнаруживается у людей и связан с умственной отсталостью. Хотя была предложена последовательная нумерация хромосом (Cho et al ., 1997) 3 . Эта историческая классификация хромосом на морфологические группы сохранилась и у кошек.Классическая хромосомная номенклатура, которая представляет хромосомы по размеру и теломерному положению, все еще широко используется для представления кариотипа и идеограмм кошек. Следовательно, у кошек есть три большие метацентрические хромосомы (от A1 до A3), четыре большие субтеломерные хромосомы (от B1 до B4), две метацентрики среднего размера (от C1 до C2), четыре малых субтеломерных хромосомы (от D1 до D4), три малых метацентрика (от E1 до E3 ) и два маленьких акроцентрика (F1 и F2). Х-хромосома среднего размера и субтеломерная, похожа на хромосому B4.Все Felidae имеют кариотип, аналогичный кариотипу домашней кошки, и кошачий кариотип очень характерен для большинства плотоядных животных.
Раннее окрашивание хромосом позволило выявить некоторые серьезные изменения в геноме кошачьих, в частности Робертсоновскую транслокацию F1 и F2 с образованием хромосомы C3 в линии оцелотов у кошек из Южной Америки (2N = 36) 59 . Незначительные перицентрические инверсии, добавления или делеции малых хромосом вызывают вариации кариотипа кошачьих; однако в целом домашние кошки имеют хромосомную архитектуру, которая очень характерна для всех кошачьих и является наследственной для большинства хищников. 34,44 Перицентрическая инверсия хромосомы F1 дает небольшую, более центромерную хромосому и обозначается как E4 у многих видов кошек.
Исторически первым генетическим аргументом, объясняющим пониженную фертильность или интерсекс кошек, являются хромосомные различия, особенно потеря одной из половых хромосом. Кариотипический, а теперь и генный анализ — распространенные методы, позволяющие определить, есть ли у кошки с неоднозначными гениталиями50 или плохим репродуктивным анамнезом хромосомные аномалии.Кариотипические исследования самцов черепаховых кошек показали, что они часто представляют собой мозаику или химеры, имеющие XX / XY во всех или некоторых тканях. Проблемы фертильности у бенгальской породы кошек, являющейся гибридом этих двух видов. Другие значительные хромосомные аномалии, вызывающие общие «синдромы», у кошек недостаточно документированы.
* Каталожные номера 2, 4, 7, 10, 14, 19, 20, 42, 54 .
Хромосомный рисунок домашней кошки
Достаточное разнообразие размеров кошачьих хромосом также позволило легко сортировать кошачьи хромосомы. 56 Хромосомная окраска показала, что организация генома кошки в высшей степени консервативна по сравнению с человеческими хромосомами. Например, плечо p хромосомы 1 (1p) человека в основном состоит из тех же генов, что и на хромосоме кошки, обозначенной как C1, тогда как хромосома 1q человека состоит из генов, обнаруженных на хромосоме кошки F1.Техника окраски хромосом также выполняется взаимно, что подразумевает нанесение кошачьих хромосом на митотические хромосомы человека и человеческие хромосомы на митотические хромосомы кошек, демонстрируя высокую сохранность хромосомного расположения кошки для человека, 56,61 , в частности, по сравнению с мышами. 53 Таким образом, раскраска хромосом является отличным обзором организации генома кошки, 38 , что значительно облегчает подходы к генам-кандидатам, поскольку расположение определенных генов можно предвидеть у кошек при сравнении с генетической картой человека. 55 Это дополнительное подтверждение сохранения для человека в отношении организации генома также поддержало развитие дополнительных генетических ресурсов для кошки как ценной животной модели заболевания человека.
Список литературы
2. Centerwall WR, Benirschke K: Животная модель синдрома XXY Клайнфельтера у человека: самцы черепахового панциря и ситца,
Am J Vet Res 36: 1275, 1975.
3. Cho KW, Youn HY, Watari T. et al. : Предлагаемая номенклатура кариотипа домашней кошки, Cytogenet Cell Genet 79:71, 1997.
4. Chu EHY, Thuline HC, Norby DE: триплоидно-диплоидный химеризм у самца черепаховой кошки, Cytogenetics 24: 1, 1964.
7. Донкастер L: О наследовании черепахового панциря и родственных ему окрасов у кошек, Proc. Camb Philol Soc 13:35, 1904.
10. Грегсон Н.М., Измаил Дж .: Диплоидный триплоидный химеризм у трех черепаховых кошек, Res Vet Sci 12: 275, 1971.
14. Исихара Т.: Цитологические исследования самцов черепахового окраса. , Cytologia 21: 391, 1956.
19. Kosowska B, Januszewski A, Tokarska M et al: Цитогенетические и гистологические исследования черепаховых кошек, Med Weter 57: 475, 2001.
20. Kuiper H, Hewicker-Trautwein M, Distl O: [Цитогенетические и гистологические исследование четырех кошек черепахового окраса], Dtsch Tierarztl Wochenschr 110: 457, 2003.
34. Nash WG, O’Brien SJ: Консервативные области гомологичных хромосом с G-полосой между порядками в эволюции млекопитающих: плотоядные животные и приматы, Proc Natl. Acad Sci USA 79: 6631, 1982.
38. О’Брайен С.Дж., Винберг Дж., Лион Л.А.: Сравнительная геномика: уроки кошек, Trends Genet 13: 393, 1997.
42. Пайл Р.Л., Паттерсон Д.Ф., Хейр В.К. и др.: Конституция половой хромосомы XXY в Гималайская кошка с остриями панциря черепахи, J Hered 62: 220, 1971.
44. Rettenberger G, Klett C, Zechner U et al: Анализ ZOO-FISH: кариотипы кошек и человека очень напоминают предполагаемый кариотип предков млекопитающих, Chromosome Res 3: 479, 1995.
47. Ronne M: Локализация хрупких участков в кариотипе Felis catus, Hereditas 122: 279, 1995.
48. Ronne M, Storm CO: Кариотип Felis catus с высоким разрешением с полосами RBG, In Vivo 6: 517, 1992.
49. Ronne M, Storm CO: Локализация ориентиров и полос в кариотипе Felis catus, Cytobios 81: 213, 1995.
52. Shibasaki Y, Flou S , Ronne M: R-полосный кариотип Felis catus, Cytobios 51:35, 1987.
53. Stanyon R, Yang F, Cavagna P et al: Картина реципрокных хромосом показывает, что геномная перестройка между крысой и мышью происходит в десять раз быстрее, чем между людьми и кошками, Cytogenet Cell Genet 84: 150, 1999.
54. Тулин HC: черепаховый самец, химеризм и истинный гермафродитизм, J Cat Genet 4: 2, 1964.
55. Винберг Дж., Станьон Р.: Хромосомная окраска у млекопитающих как подход к сравнительной геномике, Curr Opin Genet Dev 5: 792 , 1995.
56. Винберг Дж., Станьон Р., Нэш В. Г. и др.: Сохранение организации генома человека и кошки, выявленное с помощью окраски реципрокных хромосом, Cytogenet Cell Genet 77: 211, 1997.
57. Wurster-Hill DH, Centerwall WR: Взаимосвязь паттернов хромосомных полос у псовых, куньих, гиен и кошачьих, Cytogenet Cell Genet 34: 178, 1982.
58. Wurster-Hill DH, Doi T, Izawa M et al: Исследование полосовых хромосом кошки Iriomote , J Hered 78: 105, 1987.
59. Wurster-Hill DH, Gray CW: паттерны полос Гимзы в хромосомах двенадцати видов кошек (Felidae), Cytogenet Cell Genet 12: 388, 1973.
60. Wurster-Hill DH, Gray CW: взаимосвязи паттернов полос хромосом у проционид, виверрид и кошачьих, Cytogenet Cell Genet 15: 306, 1975.

 Эта пальма отличается гигантскими размерами (13-15 м в высоту), а ствол до 75 см в диаметре. Имеет чрезвычайно плотную древесину, которую сложно пилить даже хорошими пилами. Но для нас это не принципиально — декоративность кариоты тупой в листьях — дважды-перистые ваи состоят из множества листочков, которые имеют форму веера, с волнистым краем. Черешки листьев покрыты черными волокнами, т.е. растет почти черный ствол. Кстати, плоды этой пальмы очень раздражающие и токсичные (содержат оксалаты). Этот вид легко спутать с кариотой мягкой, главное отличие — в строение сегментов листьев: у кариоты мягкой треугольные волнистые листочки образуют по середине острый угол, клин, а у кариоты тупой листочки по форме с ровным, несколько скошенным краем, верхний сегмент листа рассечен, у молодого листа образует практически круг.
Эта пальма отличается гигантскими размерами (13-15 м в высоту), а ствол до 75 см в диаметре. Имеет чрезвычайно плотную древесину, которую сложно пилить даже хорошими пилами. Но для нас это не принципиально — декоративность кариоты тупой в листьях — дважды-перистые ваи состоят из множества листочков, которые имеют форму веера, с волнистым краем. Черешки листьев покрыты черными волокнами, т.е. растет почти черный ствол. Кстати, плоды этой пальмы очень раздражающие и токсичные (содержат оксалаты). Этот вид легко спутать с кариотой мягкой, главное отличие — в строение сегментов листьев: у кариоты мягкой треугольные волнистые листочки образуют по середине острый угол, клин, а у кариоты тупой листочки по форме с ровным, несколько скошенным краем, верхний сегмент листа рассечен, у молодого листа образует практически круг.
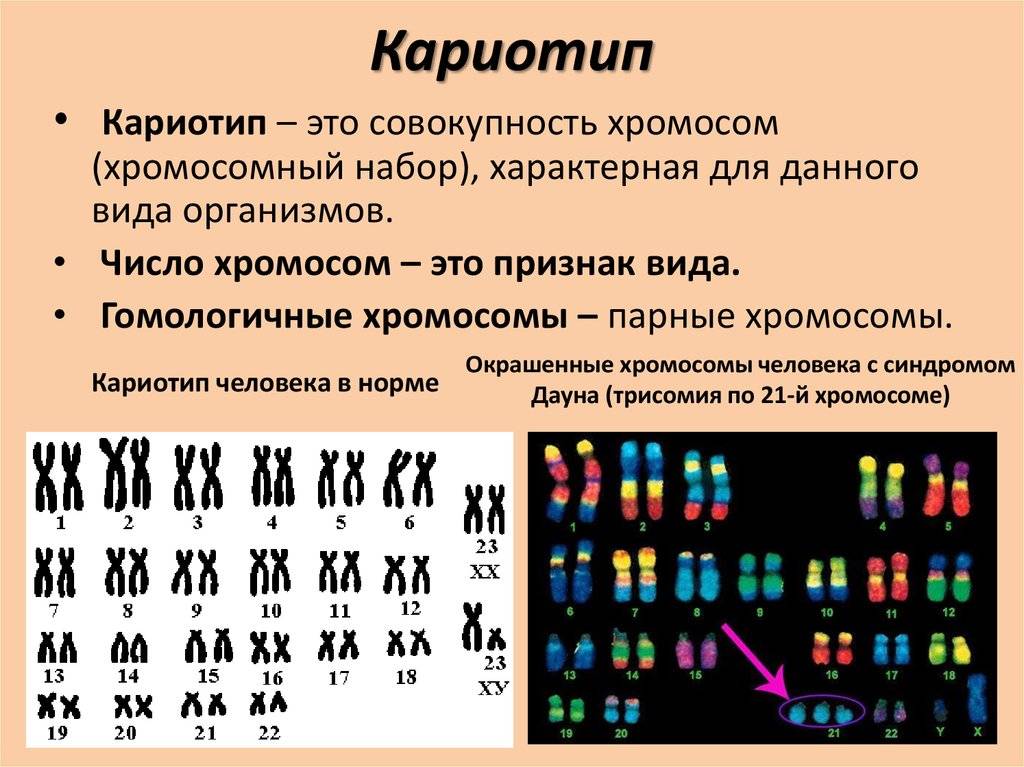


 Среду меняли каждые три дня, и субкультивирование проводили, когда клетки становились конфлюэнтными на 70–80%.
Среду меняли каждые три дня, и субкультивирование проводили, когда клетки становились конфлюэнтными на 70–80%.